Իզոտոպ, զանգվածային թիվ, հարաբերական ատոմային զանգված
Միևնույն քիմիական տարրի ատոմների տարրատեսակները, որոնք ունեն միջուկի նույն լիցքը, բայց տարբեր զանգվածային թվեր, կոչվում են իզոտոպներ:
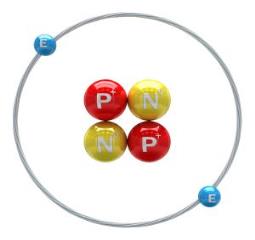
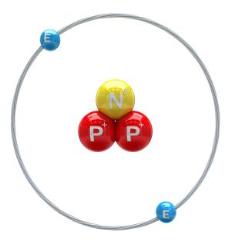
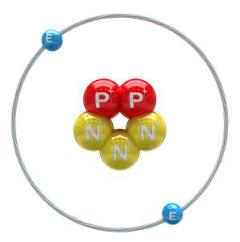
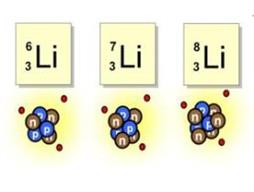
Հելիումի իզոտոպները
Քիմիական տարրի կարևորագույն, որոշիչ հատկանիշը նրա ատոմի միջուկում առկա պրոտոնների թիվն է՝ կարգաթիվը: Հետևաբար՝ նույն տարրի բոլոր իզոտոպների համար կարգաթիվը նույնն է:
Հելիումի բոլոր իզոտոպներում պրոտոնների թիվը հավասար է երկուսի, այսինքն կարգաթիվը՝ \(Z(He)=2\), որը հաճախ չի գրվում:
Իզոտոպը բնութագրվում է երկու մեծությամբ ().
- \(Z\)-միջուկի դրական լիցք - գրվում է քիմիական նշանի ձախ-ներքևի մասում,
- \(A\)- զանգվածային թիվ - գրվում է ձախ-վերևի մասում:
Բառացի «իզոտոպ» նշանակում է՝ իզո-հավասար, նույն և տոպ- տեղ, այսինքն՝ նույն տեղը:
Իզոտոպները ներկայացվում են տարբեր ձևերով: Օրինակներ՝

Նեյտրոնների թիվը միջուկում հաշվում են հետևյալ բանաձևի միջոցով՝ \(N=A-Z\)
Տարրերի մի մասն ունեն բնական կամ արհեստական ստացված ռադիոիզոտոպներ, որոնք բնութագրվում են կիսատրոհման պարբերությամբ: Դա այն ժամանակամիջոցն է, որի ընթացքում ռադիոակտիվ նմուշի քանակությունը կիսվում է:
Գրեթե բոլոր տարրերն ունեն իզոտոպներ, որոնք բնության մեջ տարածված են ոչ համաչափ:
Օրինակ՝
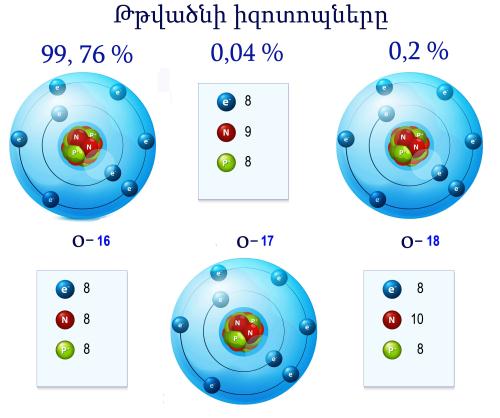
Ի դեպ, բերված տոկոսները զանգվածային բաժիններ չեն ցույց տալիս, այլ ատոմների մոլային բաժիններ են ցույց տալիս:
Ածխածնի բոլոր հայտնի իզոտոպները, որոնցից կայուն են միայն երկուսը՝ \(C-12\), \(C-13\), մյուսների կիսատրոհման պարբերությունները խիստ տարբերվում են իրարից և տատանվում են մի քանի վայրկյանից մինչև մի քանի հազար տարի միջակայքում:

Ռադիոակտիվ իզոտոպները մեծ կիրառություն ունեն: Օրինակ \(C-14\) իզոտոպը հիմք է ծառայում օրգանական ծագում ունեցող գտածոների տարիքի որոշման համար:
Որոշ իզոտոպներ, օրինակ՝ \(O-18\) և \(H-2\) իզոտոպներն օգտագործվում են ռեակցիաների մեխանիզմները բացահայտելու համար:
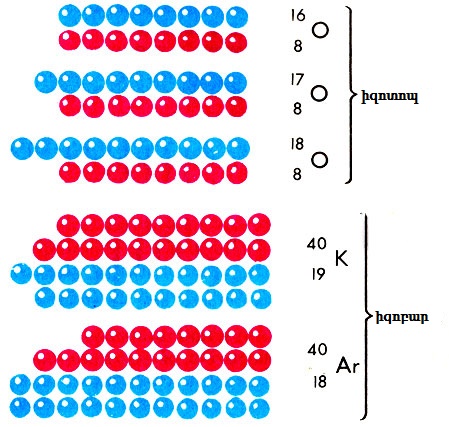
Գոյություն ունեն, այսպես կոչված, իզոբարներ, որոնք ի տարբերություն իզոտոպների, ունեն հավասար զանգվածային թվեր: Օրինակ՝
Հարկ է նշել, որ տարրի հարաբերական ատոմային զանգվածը միջին մեծություն է, պայմանավորված է տարրի իզոտոպային բաղադրությամբ, ամբողջ թիվ չէ, սակայն շատ մոտ է առավել տարածված իզոտոպի զանգվածային թվին:
Աղբյուրները
Ա․ ԽԱՉԱՏՐՅԱՆ, Լ․ ՍԱՀԱԿՅԱՆ
Քիմիա-10, Երևան-2010