Օքսիդացման աստիճան
Օքսիդացման աստիճանը միացությունում ատոմի պայմանական լիցքն է, որը նա կունենար, եթե կապերը լինեին իոնային:
Օքսիդացման աստիճանը թեև պայմանական մեծություն է, սակայն, քիմիա գիտության զարգացման ներկայիս փուլում շատ կարևոր հասկացություն է և, կարծես, միավորում է թե՛ կովալենտային, թե՛ իոնային կապով միացությունները: Այն կարելի է պատկերացնել որպես լրիվ կամ մասամբ տեղաշարժված էլեկտրոնների թիվ:
Այն կարող է ունենալ դրական, բացասական, կոտորակային և, նույնիսկ, զրո արժեքներ:
Օրինակ՝ պարզ նյութերում ատոմի օքսիդացման աստիճանը զրո է, քանի որ էլեկտրոնի տեղաշարժ չկա:
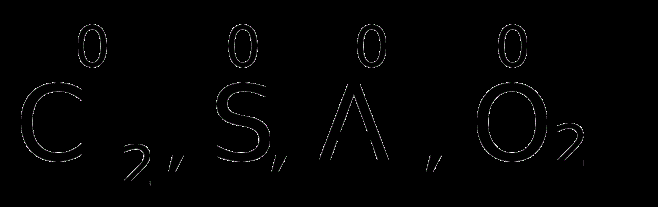
Քիմիական կապ առաջանալիս դեպի տվյալ ատոմը տեղաշարժված էլեկտրոնների թվով որոշվում է բացասական օքսիդացման աստիճանը, իսկ տվյալ ատոմից դեպի այլ ատոմ տեղաշարժված էլեկտրոնների թվով՝ բացասական օքսիդացման աստիճանը:
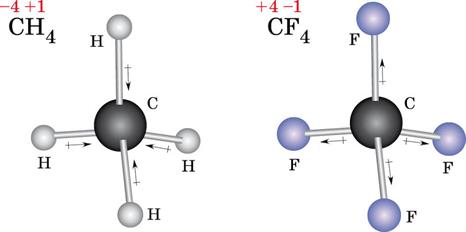
Օրինակ՝ ածխածնի օքսիդացման աստիճանը մեթանում \(-4\) է, քանի որ էլեկտրոնները տեղաշարժվում են դեպի ածխածին, իսկ ֆտորի հետ միացությունում, հակառակը՝ \(+4\)
\( \)
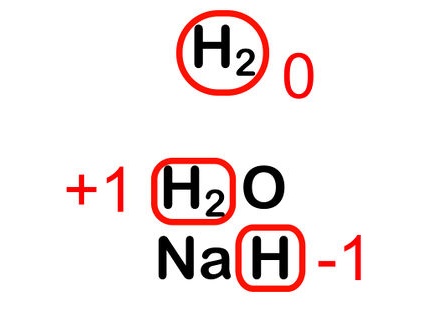
Ջրածինը կարող է դրսևորել \(0,\)\(+1\) և \(-1\) օքսիդացման աստիճաններ:
Հասկանալի է, որ միացության մոլեկուլում առավել մեծ էլեկտրաբացասականություն ունեցող տարրը կունենա բացասական օքսիդացման աստիճան և հակառակը:
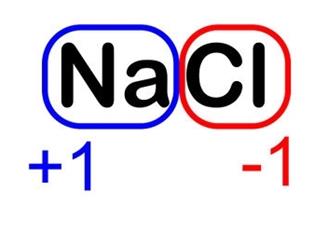
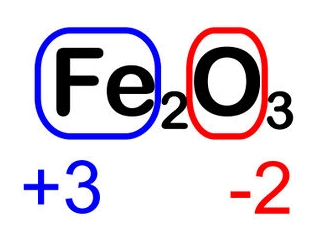
Կան հաստատուն և փոփոխական օքսիդացման աստիճան ունեցող տարրեր: Օրինակ ֆտորը բոլոր միացություններում ունի \(-1\) օքսիդացման աստիճան, օքսիդներում, թթուներում, հիմքերում և աղերում ջրածինն ունի \(+1\), իսկ թթվածինը՝ \(-2\) օքսիդացման աստիճաններ:
Միացության մոլեկուլում բոլոր տարրերի օքսիդացման աստիճանների հանրահաշվական գումարը հավասար է զրոյի:
Այս կանոնը կիրառելով հաշվում են փոփոխական օքսիդացման աստիճան ունեցող տարրի ատոմի օքսիդացման աստիճանը: Օրինակ՝
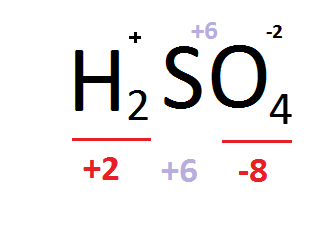
Ուշադրություն
Բարդ իոնում բոլոր տարրերի օքսիդացման աստիճանների հանրահաշվական գումարը հավասար է իոնի լիցքին:
Այս կանոնի միջոցով հաշվում են փոփոխական օքսիդացման աստիճան ունեցող տարրի ատոմի օքսիդացման աստիճանը բարդ իոնում: Օրինակ՝
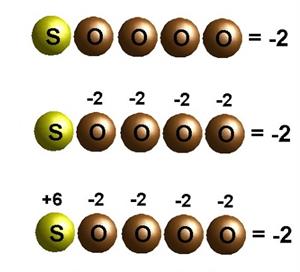
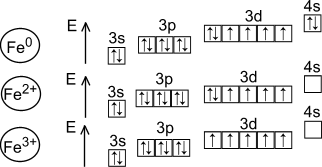
Տարրի դրսևորած տվյալ օքսիդացման աստիճանին համապատասխանում է ատոմի էլեկտրոնային թաղանթի որոշակի կառուցվածք: Օրինակ՝
Աղբյուրները
Ա․ ԽԱՉԱՏՐՅԱՆ, Լ․ ՍԱՀԱԿՅԱՆ
Քիմիա-10, Երևան-2010