Մենք դիտարկեցինք կովալենտային կապի առաջացումը նույն տարրերի ատոմների միջև` պարզ նյութերի մոլեկուլներում: Սակայն հայտնի են մեծ թվով բարդ նյութեր, որոնք տարբեր ոչ մետաղների քիմիական միացություններ են: Այսպես, ջրածինը քիմիական միացություններ է առաջացնում բոլոր ոչ մետաղների հետ, բացի իներտ գազերից, օրինակ՝ ջուրը` , մեթանը՝ և այլն:
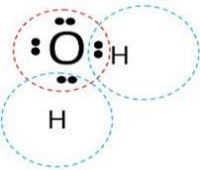
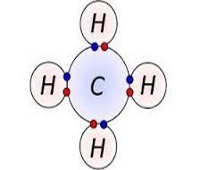
Այս դեպքում նույնպես ատոմների միջև կովալենտային կապեր են առաջանում, սակայն պարզվում է, որ տարբեր տարրերի ատոմներ միանալիս՝ նրանցից մեկն առավել մեծ չափով է դեպի իրեն ձգում ընդհանուր էլեկտրոնային զույգը:
Այն ատոմները, որոնց արտաքին էլեկտրոնային շերտի լրացման համար քիչ թվով էլեկտրոններ են պահանջվում, քիմիական կապ առաջացնելիս էլեկտրոնները դեպի իրենց ձգելու հակում ունեն:
Քիմիական միացության մոլեկուլում կապն իրականացնող էլեկտրոնային զույգը դեպի իրեն ձգելու ատոմի հատկությունն անվանվում է էլեկտրաբացասականություն (ԷԲ):
Որքան հեշտ է տվյալ ատոմը այլ տարրի ատոմից էլեկտրոններ ձգում դեպի իրեն, այնքան մեծ է այդ ատոմի էլեկտրաբացասականությունը:
էլեկտրաբացասականությունը հարաբերական մեծություն է:
Ամենամեծ հարաբերական էլեկտրաբացասականությամբ օժտված է ֆտորը, այն հավասար է չորսի:
Որպես միավոր՝ ընդունված է լիթիում (Li) տարրի էլեկտրաբացասականությունը:
Պարբերություններում՝ ձախից աջ, կարգաթվի աճման հետ տարրերի ատոմների էլեկտրաբացասականությունը մեծանում է, իսկ խմբերում՝ վերևից ներքև՝ փոքրանում:
Ամենամեծ էլեկտրաբացասականությամբ օժտված են՝ ֆտոր, թթվածին, ազոտ, քլոր տարրերի ատոմները, ամենափոքրով՝ ալկալիական մետաղների ատոմները:
էլեկտրաբացասականության արժեքները քիմիական տարրերի ոչ մետաղականության չափանիշներն են:
Այն քիմիական կապը, որն առաջանում է ոչ մետաղների ատոմների միջև՝ դեպի առավել էլեկտրաբացասական տարրի ատոմը՝ շեղված էլեկտրոնային զույգի միջոցով, անվանվում է կովալենտային բևեռային: