էլեկտրոլիտային դիսոցման մեխանիզմը

Նյութի պատկանելիությունը էլեկտրոլիտներին կամ ոչ էլեկտրոլիտներին որոշվում է քիմիական կապի տեսակով:

Էլեկտրոլիտներ են իոնային կամ ուժեղ բևեռային կապով միացությունները:
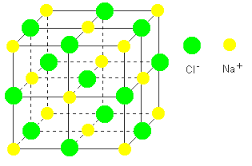
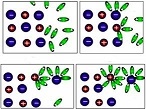
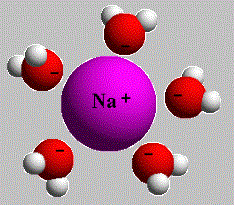
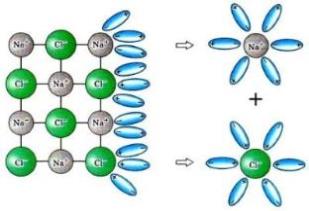
Ջրում լուծելիս նատրիումի քլորիդի բյուրեղավանդակի հանգույցներում գտնվող իոնների և ջրի երկբևեռ (դիպոլ) մոլեկուլների միջև տեղի է ունենում էլեկտրաստատիկական՝ իոն-դիպոլային փոխազդեցություն՝ իոնների հիդրատացում, ինչի արդյունքում հիդրատացված իոնները բյուրեղավանդակից պոկվում և բաշխվում են լուծույթի ողջ ծավալում.
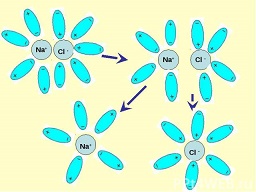
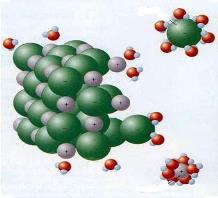
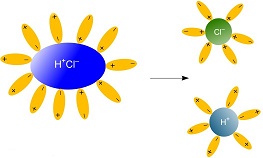
Կովալենտային բևեռային կապով միացությունները, օրինակ՝ քլորաջրածինը՝ \(HCl\) ջրում լուծելիս վերջինիս և ջրի երկբևեռ մոլեկուլների միջև տեղի է ունենում էլեկտրաստատիկական՝ դիպոլ-դիպոլային փոխազդեցություն, ինչը կրկին հանգեցնում է հիդրատացված իոնների առաջացման և մոլեկուլների տրոհման.
Ուշադրություն
Ջրային լուծույթներում էլեկտրոլիտների դիսոցման հիմնական պատճառը իոնների հիդրատացումն է:
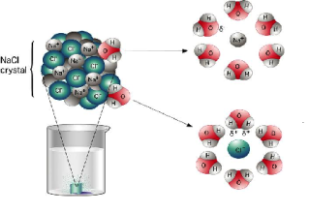
Դիսոցման գործընթացում շատ կարևոր է լուծիչի դերը: Օրինակ՝ կերակրի աղը լուծվում և դիսոցվում է ջրում, սակայն որոշ չափով լուծվում է նավթում , բայց չի դիսոցվում:
Ուշադրություն
Ոչ բևեռային մոլեկուլներով լուծիչներում էլեկտրոլիտները չեն դիսոցվում:
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015