Իոնափոխանակման ռեակցիաներ:

Էլեկտրոլիտային դիսոցման տեսության հիմնական դրույթներին ծանոթանալուց հետո քեզ համար դժվար չի լինի պատկերացնել, որ լուծույթում ընթացող փոխանակման ռեակցիաները հիմնականում իոնափոխանակման ռեակցիաներ են, այսինքն՝ փոխանակումը տեղի է ունենում իոնների միջև:
Ջրային լուծույթներում էլեկտրոլիտների իոնների մասնակցությամբ ընթացող ռեակցիաներն անվանում են իոնափոխանակման:
Իոնափոխանակման ռեակցիներն ընթանալոմ են մինչև վերջ, երբ
*ջրում չլուծվող նյութ՝ նստվածք է առաջացում
*գազային նյութ է առաջացում
*քիչ դիսոցվող նյութ՝ թույլ էլեկտրոլիտ է առաջացում
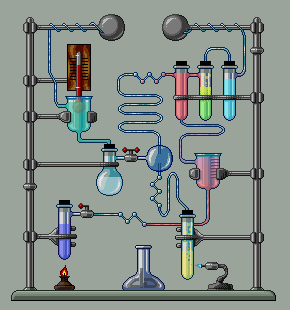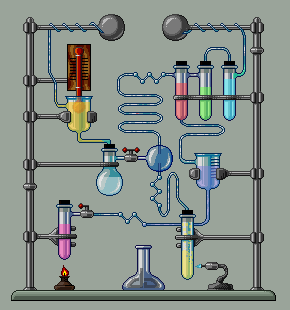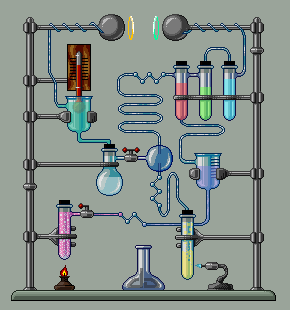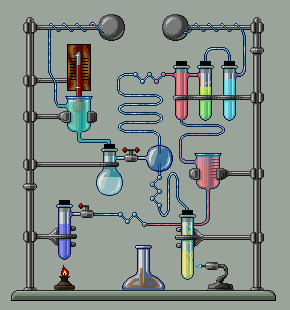
Համապատասխան օրինակները բերված են նկարում:
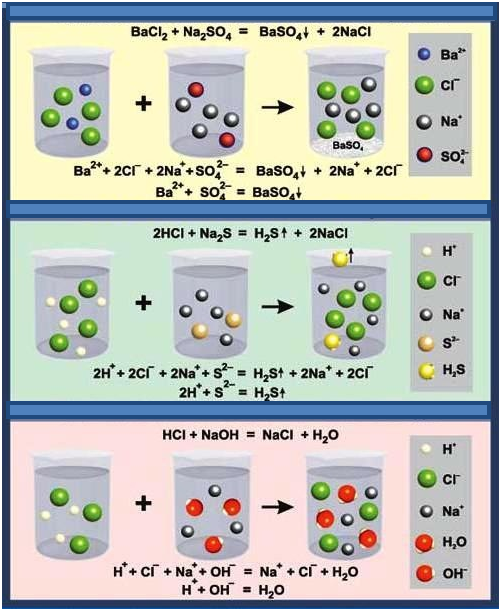
Ինչպես նկատեցիր, բացի մոլեկուլային հավասարումներից ներկայացված են նաև լրիվ իոնային և կրճատ իոնային հավասարումները.
Իոնային հավսարումներ գրելիս միայն ուժեղ էլեկտրոլիտներն են դիսոցված ձևով ներկայացնում, իսկ ոչ էլեկտրոլիտները և թույլ էլեկտրոլիտները՝ մոլեկուլների ձևով:
Կրճատ իոնային հավասարումներ գրելիս անհրաժեշտ է կատարել նաև մաթեմատիկական կրճատումներ.
օրինակ.
լրիվ իոնային հավասարում.
կրճատ իոնային հավասարում.
կրճատ իոնային հավասարման վերջնական տեսքը.
Իսկ երբեմն կրճատվող մասնիկներ չեն լինում և կրճատ իոնային հավասարումը համընկնում է լրիվ իոնային հավասարման հետ.
օրինակ.
լրիվ իոնային հավասարում.
ինչպես նկատում ենք, կրճատվող մասնիկներ չկան:
Կրճատ իոնային հավասարումների կարևորությունը կայանում է նրանում, որ ակնառու է դառնում, թե հատկապես ո՞ր մասնիկների միջև է ընթանում տվյալ ռեակցիան:
Իոնափոխանակման ռեակցիաներ, հիմնականում, ընթանում են հետևյալ նյութերի միջև.
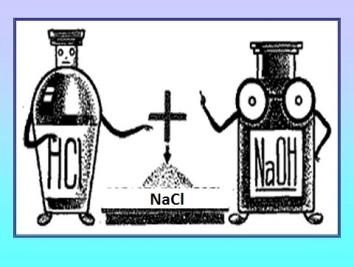
*թթուների և հիմքերի (չեզոքացման ռեակցիա).
ի դեպ՝ բոլոր ուժեղ թթուների և բոլոր ուժեղ հիմքերի միջև ընթացող չեզոքացման ռեակցիաներին համապատասխանում է միևնույն կրճատ իոնային հավասարումը, այն է՝
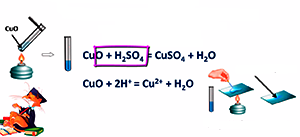
*թթուների և հիմնային օքիդների.
բոլոր դեպքերում կրճատ իոնային հավասարումը ներառում է ջրածնի կատիոնը՝ և հիմնային օքսիդի մոլեկուլը.
Կոնկրետ օրինակը բերված է նկարում.
*թթուների և աղերի.
հնարավոր են երեք հիմնական տարբերակներ.
ա. առաջանում է չլուծվող աղ
բ. առաջանում է չլուծվող թթու
գ. առաջանոմ է ցնդող թթու
օրինակ.
ա.
բ.
գ.

*ալկալիների և թթվային օքսիդների.
բոլոր դեպքերում կրճատ իոնային հավասարումը ներառում է ալկալու անիոնը՝ և թթվային օքսիդի մոլեկուլը.
օրինակ՝
*ալկալիների և աղերի.
հնարավոր են երեք հիմնական տարբերակներ.
ա. առաջանում է չլուծվող աղ
բ. առաջանում է չլուծվող հիմք
գ. առաջանում է ցնդող հիմք.
օրինակ
ա.
բ.
գ.
* երկու աղերի միջև.
նոր առաջացող աղերից առնվազն մեկը պետք է անջատվի նստվածքի ձևով
օրինակ
Հնարավոր են այնպիսի իոնափոխանակման ռեակցիաների դեպքեր, երբ միաժամանակ
առաջանում են և՛ նստվածք, և՛ գազ, և՛ թույլ էլեկտրոլիտ.
օրինակ.
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015