Երկաթ

Երկաթի կայուն իզոտոպներն են՝

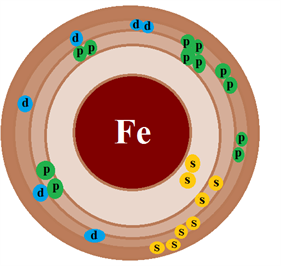
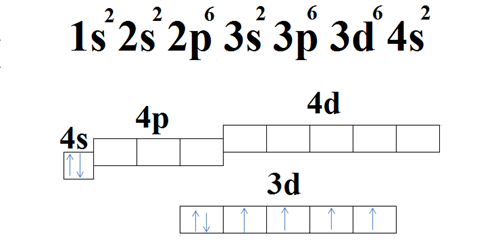
Ատոմի էլեկտրոնային կառուցվածքը հիմնական վիճակում՝
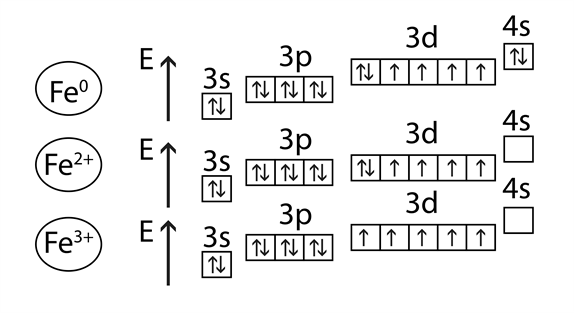
Միացություններում ցուցաբերում է հիմնականում \(+2\) և \(+3\) օքսիդացման աստիճաններ՝
Երկաթը բնության մեջ
Երկաթի հինական բնական միացություններն են՝

Ստացումը
Արդյունաբերության մեջ ստացվում է դոմենյան վառարանում բարձր ջերմաստիճանի պայմաններում երկաթահանքերից`
Մաքուր երկաթ ստացվում է բարձր ջերմաստիճանային պայմաններում՝ երկաթի օքսիդները ջրածնով վերականգնելով.
Երկաթի օքսիդները վերականգնում են նաև ալյումինով (ալյումինաթերմիա).
Ֆիզիկական հատկությունները

Սպիտակ արծաթափայլ ծանր մետաղ է, օժտված ուժեղ մագնիսական հատկություններով, կռելիությամբ և պլաստիկությամբ: Հալվում է \( 1539 ℃\) և եռում է \(2870\ \)\(℃\) ջերմաստիճաններում:
Քիմիական հատկությունները
Միջին ակտիվության մետաղ է, օքսիդանում է մինչև \(+3՝\) ուժեղ օքսիդիչների հետ փոխազդելիս.
Օրինակ
\(+2՝\) համեմատաբար թույլ օքսիդիչներով օքսիդացնելիս.
Օրինակ
Խոնավ օդում երկաթը սովորական պայմաններում փոխազդում է թթվածնի հետ (ժանգոտվում է).
Ջրի հետ, բարձր ջերմաստիճանում.
Խիտ ազոտական և ծծմբական թթուները սովորական ջերմաստիճանում չեն օքսիդացնում երկաթը, ռեակցիան ընթանում է միայն բարձր ջերմաստիճանում:
Երկաթի միացություններից հիմնային բնույթի են, փոխազդում են թթուների հետ, իսկ օժտված են թույլ արտահայտված ամֆոտեր հատկություններով, ուստի փոխազդում են նաև ալկալիների հետ:
Երկաթի \((II)\) հիդրօքսիդը օդում արագ օքսիդանում է` փոխարկվելով երկաթի \((III)\) հիդրօքսիդի.
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015