Ալյումին

Ատոմի կառուցվածքը
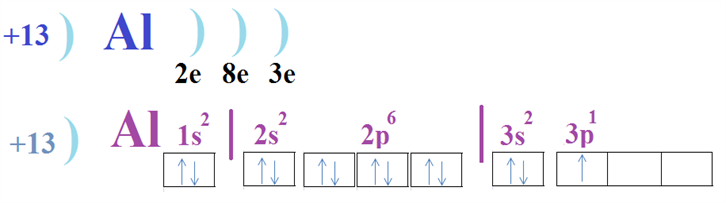
Ալյումինը \(IIIA\) խմբի տարր է, ուստի ատոմի արտաքին էներգիական մակարդակում առկա է երեք էլեկտրոն, որոնցից երկուսը զույգված են: Միացություններ առաջացնելիս՝ այդ ատոմը հիմնական վիճակից հեշտությամբ անցնում է գրգռված վիճակի, որին համապատասխանում են չզույգված երեք էլեկտրոն:
Միացություններում ալյումինի օքսիդացման աստիճանը գրեթե միշտ \(+3\)-ն է:
Ալյումինը բնության մեջ
Բնության մեջ ալյումինը ամենատարածված մետաղական տարրն է: Ազատ վիճակում չի հանդիպում: Ալյումին պարունակող հիմնական հանքանյութերն են՝


Բոքսիտ՝ Կավ՝
Ֆիզիկական հատկությունները

Ալյումինը թեթև մետաղ է (\(ρ = 2,7գ\)/սմ³), արծաթափայլ, հալման ջերմաստիճանը՝ \(660℃,\) եռում է \(2450℃\) ջերմաստիճանում, օժտված է մեծ էլեկտրա- և ջերմահաղորդականությամբ: Պլաստիկ է. մետաղական ալյումինից հեշտությամբ լար է ձգվում և փայլաթիթեղ գլանվում: Հալված ալյումինը լուծում է այլ մետաղներ և ոչ մետաղներ` թեթև ու կայուն համաձուլվածքներ առաջացնելով:
Քիմիական հատկությունները
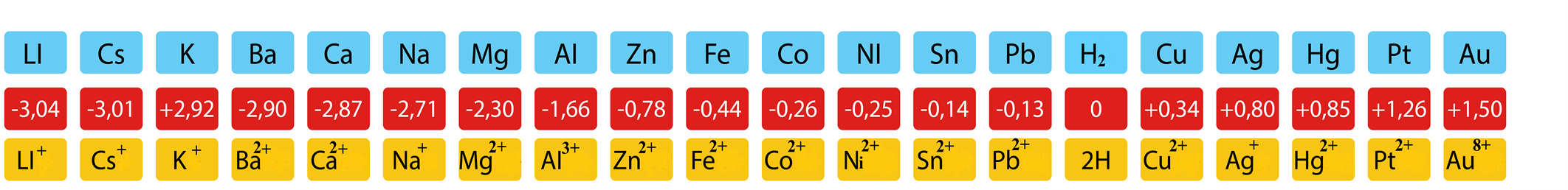
Ալյումինը շատ ակտիվ մետաղ է․ մետաղների ակտիվության շարքում տեղադրված է անմիջապես ալկալիական և հողալկալիական մետաղներից հետո:
Ոչ մետաղների հետ ալյումինը հեշտությամբ է փոխազդում` հատկապես փոշի վիճակում: Ռեակցիան սկսելու համար տաքացում է պահանջվում, բայց հետո ընթանում է արագ` անջատելով մեծ քանակությամբ ջերմություն.
Օրինակ
Ալյումինի փոշին յոդի հետ փոխազդում է սենյակային ջերմաստիճանում՝ միայն ջրի առկայությամբ, որը կատալիզատորի դեր է կատարում:

Ալյումինն օդում շատ կայուն է և սովորական ջերմաստիճանում փոփոխության չի ենթարկվում, քանի որ այդ պայմաններում ալյումինի մակերեսը պատվում է շատ կայուն օքսիդային թաղանթով, որը պաշտպանում է մետաղը հետագա օքսիդացումից:
Սակայն ալյումինի փոշին կամ բարակ թիթեղը, մինչև \(700℃\) տաքացնելիս, այրվում է` արձակելով օքսիդի շիկացած շիթեր:

Սենյակային ջերմաստիճանում ալյումինը ջրի հետ չի փոխազդում օքսիդային շերտի պատճառով: Սակայն այդ թաղանթը վերացնելիս ալյումինը փոխազդում է ջրի հետ` հիդրօքսիդ առաջացնելով.
Ալյումինը լավ լուծվում է նոսր թթուներում:
Օրինակ
Խիտ ծծմբական թթվի և ալյումինի միջև բարձր ջերմաստիճանում ընթանում է օքսիդավերականգնման ռեակցիա.
Ալյումինը լուծվում է ալկալու լուծույթում` անջատելով ջրածին.
Ալյումինի միացությունները.
Ալյումինի օքսիդ՝ Ալյումինի հիդրօքսիդ՝


Ալյումինի օքսիդը երկդիմի օքսիդ է, ուստի փոխազդում է և՛ թթուների, և՛ հիմքերի հետ.
-ը՝ երկդիմի հիդրօքսիդ է, հետևաբար հեշտությամբ լուծվում է և՛ թթուներում, և՛ հիմքերում.
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015