Մետաղների ընդհանուր բնութագիրը

«Մետաղ» բառը ծագել է հունական մետալոն արմատից, որը նշանակում է «հանք»:
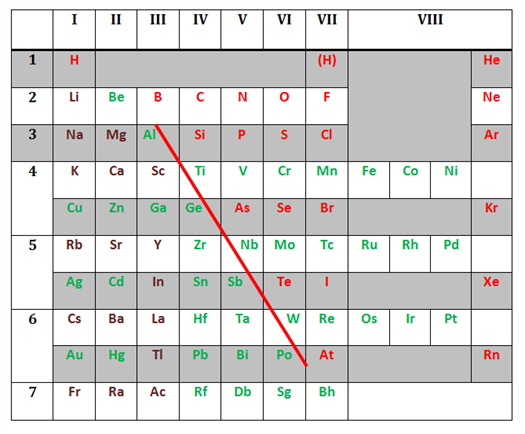
Քիմիական տարրերի դասակարգումը մետաղների և ոչ մետաղների պայմանական է: Օրինակ, բերիլիում \((Be\)), ալյումին \((Al)\) և ցինկ \((Zn)\) տարրերը մետաղներ են, բայց դրանց առաջացրած օքսիդներն ու հիդրօքսիդներն օժտված են և՛ թթվային, և՛ հիմնային հատկություններով:
Իսկ ծարիր \((Sb)\) և գերմանիում \((Ge)\) տարրերն իրենց հատկություններով ավելի մոտ են ոչ մետաղներին: Իսկ օրինակ, սիլիցիումը \((Si)\), արսենը \( (As)\) և աստատը \((At)\) ցուցաբերում են որոշ մետաղական հատկություններ:
Մետաղները քիմիական ռեակցիաներում միայն վերականգնիչներ են, ինչն էլ մետաղները և ոչ մետաղները տարբերակող առանձնահատկություն է:
Մետաղների ատոմների չափերը (շառավիղները) համեմատաբար մեծ են, ուստի դրանց արտաքին էներգիական մակարդակի էլեկտրոնները զգալիորեն հեռու են միջուկից ու վերջինիս հետ թույլ են կապված:
Մետաղների ճնշող մեծամասնությունը ատոմների արտաքին էներգիական մակարդակում ունի \(1\)-\(3\) էլեկտրոն:
Մետաղների ֆիզիկական հատկությունները
Մետաղային բյուրեղավանդակի հանգույցներում կանոնավոր տեղաբաշխված են մետաղի կատիոններ ու ատոմներ, որոնք միմյանց հետ կապված են այդ կատիոններին համապատասխան վալենտային էլեկտրոնների բազմակի վրածածկից առաջացած ընդհանուր էլեկտրոնային ամպով:
Մետաղի դրական իոնների և ընդհանուր էլեկտրոնային ամպի փոխազդեցությամբ պայմանավորված կապն էլ անվանում են մետաղական:
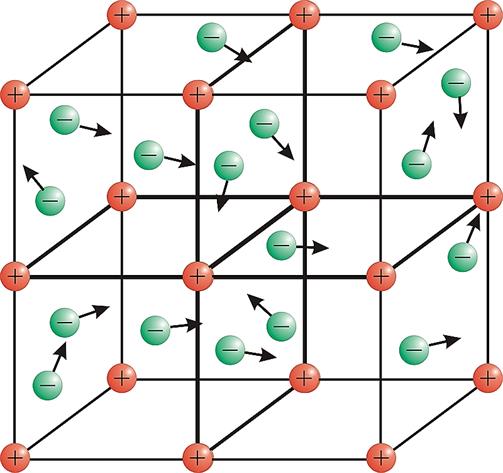
Բյուրեղավանդակի յուրահատուկ կառուցվածքը պայմանավորում է մետաղների կարևոր բոլոր ֆիզիկական հատկությունները՝ գույնը, կարծրությունը, հալման ջերմաստիճանը, խտությունը, էլեկտրահաղորդականությունը և ջերմահաղորդականությունը, մետաղական փայլն ու անթափանցիկությունը, պլաստիկությունը:
Մետաղները տարբեր գույնի են: Արտադրության ոլորտում դրանք պայմանականորեն բաժանվում են սև (երկաթն ու իր համաձուլվածքները) և գունավոր մետաղների (բոլոր մյուս մետաղները):
Սովորական պայմաններում բոլոր մետաղներին (սնդիկից բացի) հատուկ է պինդ ագրեգատային վիճակը, սակայն դրանց կարծրություններն ու հալման ջերմաստիճանները տարբեր են:
Ըստ խտության՝ մետաղները լինում են թեթև (\(ρ< 5\) գ/սմ³) և ծանր (\(ρ > 5\) գ/սմ³):
Ամենածանր մետաղն օսմիումն է՝ \(Os\) (\(ρ= 22,6\) գ/սմ³), իսկ ամենաթեթևը՝ լիթիումը՝ \(Li\) (\(ρ= 0,53\) գ/սմ³):
Մետաղները ջերմության և էլեկտրականության լավ հաղորդիչներ են:
Հարթ մակերեսներով մետաղների փայլը պայմանավորված է լուսային ճառագայթների անդրադարձմամբ:
Արտաքին ազդակների ներգործությամբ մետաղները փոխում են իրենց ձևն ու պահպանում ընդունած ձևն այդ ազդեցությունը վերացնելիս: Դա պայմանավորված է այն հանգամանքով, որ արտաքին ազդեցության ներքո իոն-ատոմների մի շերտը մյուսի նկատմամբ սահում է՝ պահպանելով մետաղական կապը:
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015