Ածխաթթու և կարբոնատներ
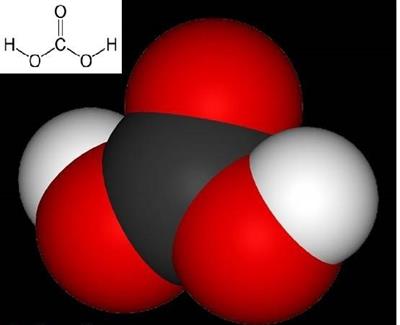
Ածխածնի \((IV)\) օքսիդը ջրում լուծվում է \(20° C\)-ում, մեկ ծավալ ջրում լուծվում է \(0,88\) ծավալ գազ: Լուծված գազի մի մասը փոխազդում է ջրի հետ առաջացնելով թթու՝ ածխաթթու (լակմուսը ներկվում է կարմիր):

Ածխաթթուն երկհիմն, շատ թույլ և նույնիսկ ջրային լուծույթում անկայուն թթու է: Այն դիսոցվում է իոնների՝ աննշան չափով, այդ իսկ պատճառով ջրային լուծույթները փոքրինչ թթվահամ են (այդ համը զգացվում է գազավորված ջուր խմելիս):

Որպես երկհիմն թթու` ածխաթթուն երկու տեսակի աղեր է առաջացնում, չեզոք՝ կարբոնատներ, և թթու՝ հիդրոկարբոնատներ:

Ջրում լուծելի են ալկալիական մետաղների ու ամոնիումի կարբոնատները, իսկ մյուս մետաղների կարբոնատները ջրում համարյա չեն լուծվում:
Անլուծելի կարբոնատները տաքացնելիս քայքայվում են:
Օրինակ
Հիդրոկարբոնատների մեծ մասը ջրում լուծվող է: Դրանք ստացվում են կարբոնատների լուծույթներն ածխաթթու գազի հետ փոխազդելիս:
Օրինակ
Հիդրոկարբոնատները ենթարկվում են ջերմային քայքայման: Կախված ջերմաստիճանից և հիդրոկարբոնատ առաջացրած մետաղի բնույթից, առաջանում է կարբոնատ կամ մետաղի օքսիդ, ածխածնի \((IV)\) օքսիդ և ջուր:
Օրինակ
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015