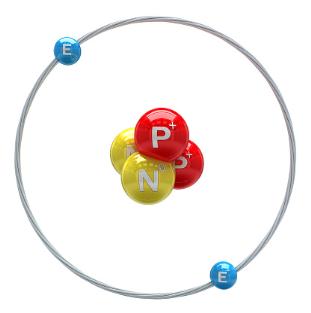
Ատոմի միջուկի կառուցվածքը:
Ինչպես արդեն գիտեք, ատոմը կազմված է միջուկից և էլեկտրոնային թաղանթից: Ատոմն էլեկտրաչեզոք է, քանի որ էլեկտրոնների գումարային լիցքը համակշռում է միջուկի դրական լիցքը:

Ատոմի բնութագրական չափը մ է, իսկ միջուկինը՝ մ, այսինքն ատոմի միջուկի շառավիղը մոտ \(100\ 000\) անգամ փոքր է ատոմի շառավղից: Չնայած դրան, ատոմի զանգվածը գործնականում հավասար է միջուկի զանգվածին:
Ատոմի միջուկը ունի բարդ կառուցվածք. այն բաղկացած է առանձին մասնիկներից, որոնք կոչվում են նուկլոններ:
\(1913\)թ Ռեզերֆորդն առաջարկեց վարկած, համաձայն որի բոլոր քիմիական տարրերի միջուկներում պարունակվում են ջրածնի միջուկներ: Նրանց Ռեզերֆորդը անվանեց պրոտոն:
Պրոտոնը դրական լիցքավորված մասնիկ է, որի զանգվածը \(1836\) անգամ մեծ է էլեկտրոնի զանգվածից, իսկ լիցքը հավասար է էլեկտրոնի լիցքի մոդուլին:
Տարբեր ատոմների միջուկները պարունակում են տարբեր թվով պրոտոններ: Ատոմի միջուկի զանգվածը հավասար չէ, այլ ավելի մեծ է այն կազմող պրոտոնների գումարային զանգվածից: Հետևաբար ատոմների միջուկներում բացի պրոտոններից կան նաև այլ մասնիկներ:
\(1932\)թ անգլիացի գիտնական Ջեյմս Չեդվիկը փորձով հայտնաբերեց մի նոր մասնիկ, որի զանգվածը \(1839\) անգամ մեծ է էլեկտրոնի զանգվածից, այսինքն մոտավորապես հավասար է պրոտոնի զանգվածին, իսկ լիցք չունի: Այդ մասնիկին նա անվանեց նեյտրոն:


Նեյտրոնի հայտնագործումից հետո, Վիկտոր Համբարձումյանի, Դմիտրի Իվանենկոյի և Վեռներ Հայզենբերգի կողմից առաջարկվեց միջուկների կառուցվածքի պրոտոն-նեյտրոնային մոդելը, որը հետագայում հիմնավորվեց բազմաթիվ փորձերով:



Համաձայն այդ մոդելի.
Ատոմի միջուկը կազմված է պրոտոններից և նեյտրոններից: Պրոտոնների թիվը միջուկում համընկնում է Մենդելեևի քիմիական տարրերի աղյուսակում տվյալ տարրի կարգաթվի՝ \(Z\)-ի հետ: Կարգաթվի հետ է համընկնում նաև ատոմում էլեկտրոնների թիվը:
Նեյտրոնների թիվը միջուկում նշանակում են \(N\) տառով:
Միջուկի պրոտոնների \(Z\) թվի և նեյտրոնների \(N\) թվի գումարն անվանում են միջուկի զանգվածային թիվ և նշանակում \(A\) տառով:
Միջուկում նեյտրոնների թիվը հավասար է միջուկի զանգվածային թվի և պրոտոնների թվի տարբերությանը:
Այն քիմիական տարրերը, որոնք ունեն նույն կարգաթիվը, այսինքն նույն թվով պրոտոններ, սակայն տարբեր ատոմային զանգվածներ, կոչվում են իզոտոպներ:
Օրինակ՝ ջրածնի իզոտոպներն են դեյտերիումը՝ և տրիտիումը՝
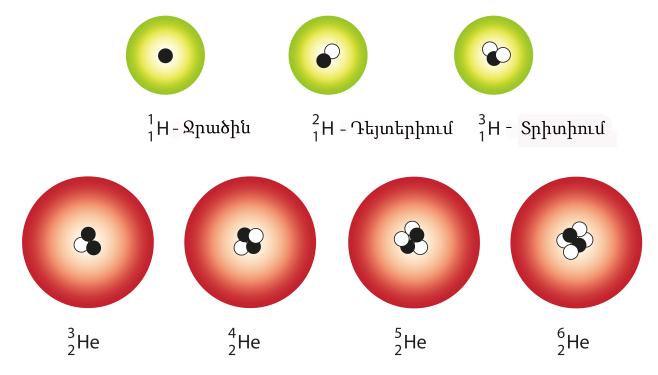
Ջրածնի միջուկը կազմված է \(1\) պրոտոնից, դեյտերիումինը՝ \(1\) պրոտոնից և \(1\) նեյտրոնից:
Տրետիումի միջուկը կազմում են \(1\) պրոտոն և \(2\) նեյտրոնը:
Հայտնի նաև \(He\)-ի \(4\) իզոտոպներ՝
Ուշադրություն
Պրոտոնների թվով պայմանավորված է ատոմի քիմիական հատկությունները, իսկ նեյտրոնների թվով՝ տվյալ քիմիական տարրի ատոմային զանգվածը:
Աղբյուրները
Ֆիզիկա և աստղագիտություն 9; Է. Ղազարյան, Ա. Կիրակոսյան, Գ. Մելիքյան, Ռ. Թոսունյան, Ս. Մաիլյան, Ս. Ներսիսյան; Երևան 2009թ
Ֆիզիկա 9; Ս. Գրոմով, Ն. Ռոդինա, խմբագրությամբ Ա. Մամյանի,; Երևան 2015թ.
Ֆիզիկա 9; Ս. Գրոմով, Ն. Ռոդինա, խմբագրությամբ Ա. Մամյանի,; Երևան 2015թ.