
















Ատոմային օրբիտալների հիբրիդացում
Հիբրիդացումը որոշ օրբիտալների ձևի փոփոխությունն է, որը կատարվում է կովալենտային կապի առաջացման ժամանակ՝ օրբիտալների առավելագույն փոխծածկում ապահովելու համար:

Ուշադրություն
Գոյացող հիբրիդային օրբիտալների թիվը նույնքան է, ինչ հիբրիդացմանը մասնակցող օրբիտալների թիվը:
Առկա ծրագրում դիտարկվում է երկրորդ պարբերության տարրերի՝ բերիլիում, բոր, ածխածին, ազոտ և թթվածին հնարավոր հիբրիդային վիճակները:

Բերիլիումի ատոմը, կովալենտային կապեր առաջացնելուց անմիջապես առաջ՝ կլանելով էներգիա, անցնում է գրգռված վիճակի, որին հետևում է հիբրիդացումը:
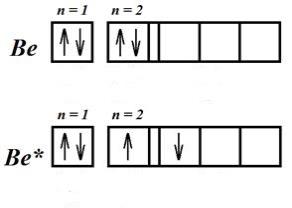
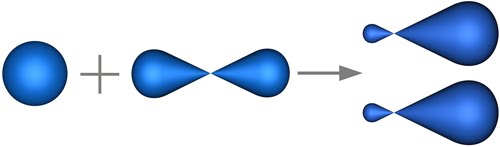
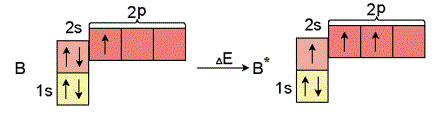
Նույն ձևով բորի ատոմը ենթարկվում է հիբրիդացման:
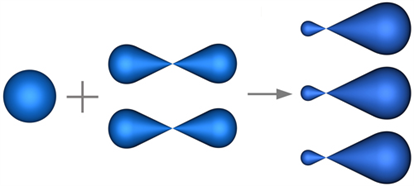

Ածխածնի ատոմին բնորոշ է առավելագույն՝ հիբրիդացումը:
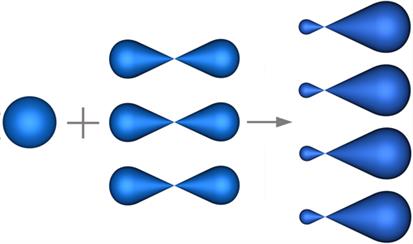

Ածխածնի ատոմին բնորոշ են նաև (ալկին) և (ալկեն) հիբրիդային վիճակները:
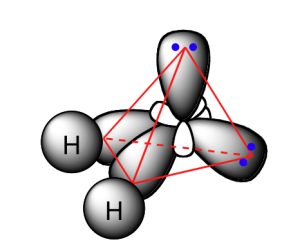
Ազոտի և թթվածնի ատոմներում վալենտային էլեկտրոնների ապազույգման հնարավորություն չկա, թե՛ ազոտի, թե՛ թթվածնի ատոմները ենթարկվում են հիբրիդացման՝ չորսական օրբիտալներով՝ հինգ և վեց էլեկտրոնների մասնակցությամբ:
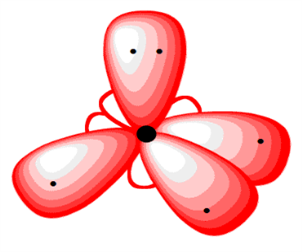
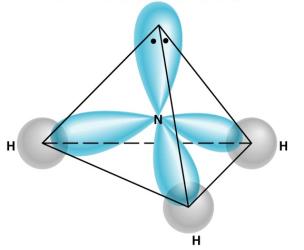
Մեկ էլեկտրոն ունեցող հիբրիդային օրբիտալների և ջրածնի ատոմների \(s\) օրբիտալների փոխծածկով առաջանում են ամոնիակի և ջրի մոլեկուլները:
Աղբյուրները
Ա․ ԽԱՉԱՏՐՅԱՆ, Լ․ ՍԱՀԱԿՅԱՆ
Քիմիա-10, Երևան-2010