
















Ատոմի կառուցվածքը

Էլեկտրոնի լիցքը՝ , իսկ զանգվածը՝

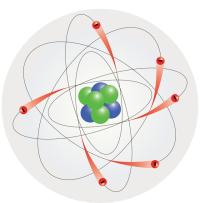
Ըստ Ռեզերֆորդի նյութի՝ յուրաքանչյուր ատոմ կարծես փոքրիկ Արեգակնային համակարգ է, որի կենտրոնում դրականապես լիցքավորված միջուկն է: Էլեկտրոնները պտտվում են միջուկի շուրջը նրա չափերից շատ ավելի մեծ հեռավորությունների վրա, ինչպես մոլորակները Արեգակի շուրջը:
Սովորական վիճակում մարմինը, ինչպես և նրա կառուցվածքային տարրերը՝ ատոմները, էլեկտրաչեզոք են: Ուրեմն վերջինիս բոլոր էլեկտրոնների գումարային լիցքի բացարձակ արժեքը հավասար է միջուկի լիցքին:
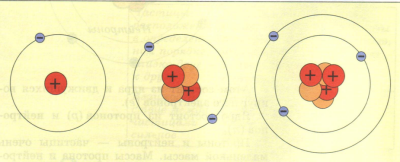
Տարբեր տարրերի ատոմները միմյանցից տարբերվում են իրենց միջուկի լիցքով և այդ միջուկի շուրջը պտտվող Էլեկտրոնների թվով:
Դ. Ի. Մենդելեևի քիմիական տարրերի պարբերական աղյուսակում տարրերի կարգաթիվը՝ \(Z\)-ը, համընկնում է սովորական վիճակում տվյալ տարրերի ատոմի մեջ պարունակվող էլեկտրոննեի թվի հետ, հետևաբար էլեկտրոնների գումարային լիցքը ատոմում հավասար է՝
Միջուկի լիցքը կլինի՝
Ատոմի միջուկը ևս բարդ կառուցվածք ունի. նրա կազմության մեջ մտնում են տարրական դրական լիցք կրող մարմիններ՝ պրոտոններ:
Պրոտոնի զանգվածը մոտ \(1840\) անգամ մեծ է էլեկտրոնի զանգվածից: Դատելով միջուկի լիցքից կարելի է պնդել.
Ատոմի միջուկում պրոտոնների թիվը հավասար է տվյալ քիմիական տարրի կարգահամարին՝ \(Z\)-ին:
Ինչպես ցույց տվեցին հետազոտությունները, բացի պրոտոններից միջուկի պարունակում է նաև չեզոք մասնիկներ, որոնց անվանում են նեյտրոններ:
Նեյտրոնի զանգվածը փոքր ինչ մեծ է պրոտոնի զանգվածից: Նեյտրոնների թիվը միջուկում նշանակում են \(N\) տառով:
Միջուկի պրոտոնների՝ \(Z \) թվի և նեյտրոնների \(N\) թվի գումարին անվանում են միջուկի զանգվածային թիվ և նշանակում \(A\) տառով:
, որտեղից՝
\(A\)-ն կարելի է որոշել Մենդելեևի աղյուսակից՝ կլորացնելով տրված տարրի հարաբերական ատոմային զանգվածը մինչև ամբողջ թիվ:
Այսպիսով, ատոմի կենտրոնում դրական լիցք ունեցող միջուկն է, որը կազմված է \(Z \) պրոտոնից և \(N\) նեյտրոնից, իսկ միջուկի շուրջը, եթե ատոմը չեզոք է, պտտվում են \(Z\) Էլեկտրոններ:
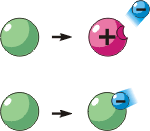
Որոշ դեպքերում ատոմները կարող են կորցնել մեկ կամ մի քանի էլեկտրոններ: Այդպիսի ատոմն այլևս չեզոք չէ, այն ունի դրական լիցք և կոչվում է դրական իոն: Հակառակ դեպքում, երբ ատոմին միանում է մեկ կամ մի քանի էլեկտրոն, ատոմը ձեռք է բերում բացասական լիցք և վեր է ածվում բացասական իոնի:
Աղբյուրները
Ֆիզիկա և աստղագիտություն 9; Է. Ղազարյան, Ա. Կիրակոսյան, Գ. Մելիքյան, Ռ. Թոսունյան, Ս. Մաիլյան, Ս. Ներսիսյան; Երևան 2009թ
Ֆիզիկա 9; Ս. Գրոմով, Ն. Ռոդինա, խմբագրությամբ Ա. Մամյանի,; Երևան 2015թ
Ֆիզիկա 9; Ս. Գրոմով, Ն. Ռոդինա, խմբագրությամբ Ա. Մամյանի,; Երևան 2015թ