
















Նյութի ֆիզիկական վիճակները
Նյութի հիմնական ֆիզիկական վիճակներն են պինդ, հեղուկ և գազային ագրեգատային վիճակները:

Պինդ և հեղուկ վիճակներում նյութը կազմող մասնիկները իրար մոտ են, միջմասնիկային հեռավորությունները համաչափելի են բուն մասնիկների չափերին: Միջմասնիկային փոխազդեցության ուժերը չափազանց մեծ են: Նշված վիճակները կոչվում են նյութի կոնդենսացված (խտացված) վիճակ:
Գազային վիճակում, ընդհակառակը, տասնապատիկ ավելի մեծ են միջմոլեկուլային հեռավորությունները և չափազանց թույլ դրանց միջև փոխազդեցության ուժերը:
Նյութը և մարմինը նկարագրող կարևորագույն ֆիզիկական հատկություններ են սեփական ծավալը, ձևը, սեղմելիությունը, խտությունը, մասնիկների շարժման բնույթը, դիֆուզիան և այլն:
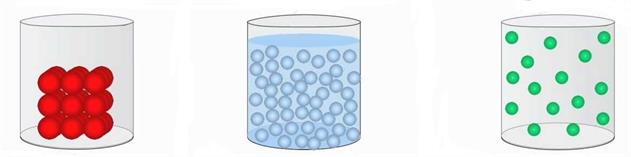
Օրինակ՝ գազերը բնութագրվում են փոքր խտությամբ, մեծ սեղմելիությամբ, դիֆուզիայի մեծ արագությամբ և այլն: Գազերը չունեն ծավալ և ձև: Գազն ընդունում է այն անոթի ձևը, որում այն գտնվում է, իսկ ծավալն էլ համընկնում է անոթի ծավալին:
Հեղուկներն ունեն որոշակի ծավալ, սակայն ընդունում են այն անոթի ձևը, որում գտնվում են, իսկ պինդ նյութերն ունեն և՛ սեփական ձև, և՛ սեփական ծավալ:
Ջերմաստիճանի ազդեցությամբ նյութը կարող է անցնել մի ագրեգատային վիճակից մյուսին, որն անվանում են ֆազային անցում:
Օրինակ՝ պինդ-հեղուկ անցումը կոչվում է հալում և բնութագրվում է հալման ջերմաստիճանով, իսկ հեղուկ-գազ անցումը կոչվում է գոլորշացում և բնութագրվում է եռման ջերմաստիճանով:
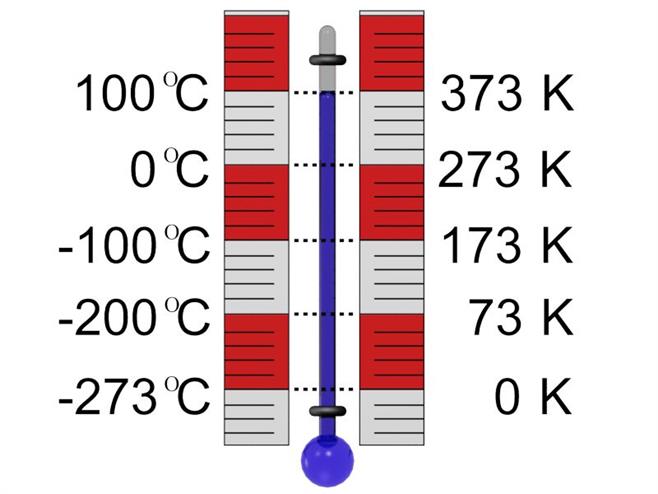
Գիտական հետազոտություններում օգտագործվում է ջերմաստիճանների երկու սանդղակ՝ Ցելսիուսի և Կելվինի: Ըստ Ցելսիուսի սանդղակի սառույցի հալման ջերմաստիճանը է, իսկ ջրի եռման ջերմաստիճանը՝ :
Կելվինի սանդղակը կոչվում է բացարձակ ջերմաստիճանների սանդղակ և տարբերվում է Ցելսիուսի սանդղակից մոտ \(273\), իսկ ավելի ճշգրիտ՝ \(273,15\) աստիճանով՝
Մոլեկուլային և ոչ մոլեկուլային կառուցվածքով նյութեր
Կախված պինդ ագրեգատային վիճակում նյութը կազմող մասնիկների և նրանց միջև փոխազդեցության ուժերի բնույթից, բոլոր նյութերը բաժանվում են չորս խմբի:
Օրինակ՝
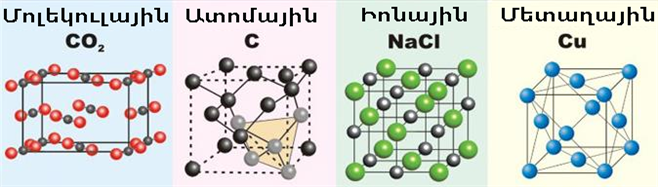

Մոլեկուլային կառուցվածքով նյութերը բաղկացած են մոլեկուլներից: Նրանց բյուրեղավանդակի հանգույցներում գտնվում են առանձին մոլեկուլներ, որոնց միջև գործում են համեմատաբար թույլ միջմոլեկուլային ուժեր: Սովորական պայմաններում դրանք գազերն են, հեղուկները և ցածր հալման և եռման ջերմաստիճան ունեցող պինդ նյութերը:
Ատոմային և իոնային կառուցվածքով նյութերի բյուրեղավանդակների հանգույցներում գտնվող ատոմների և իոնների միջև գործում են ամուր կովալենտային և իոնային կապեր, ինչի հետևանքով այդ նյութերը գտնվում են միայն պինդ ագրեգատային վիճակում և ունեն բարձր հալման ջերմաստիճան:
Մետաղների բյուրեղավանդակի հանգույցներում գտնվում են մետաղի դրական իոններ, իսկ բյուրեղի ողջ ծավալում՝ ընդհանրացված էլեկտրոններ: Մետաղների հալման ջերմաստիճանները տատանվում են շատ լայն տիրույթում:
Աղբյուրները
Ա․ ԽԱՉԱՏՐՅԱՆ, Լ․ ՍԱՀԱԿՅԱՆ
Քիմիա-10, Երևան-2010