
















Քիմիական կապի առաջացման հիմնական շարժիչ ուժն ատոմի՝ \(8\) էլեկտրոն պարունակող արտաքին էներգիական մակարդակ ունենալու ձգտումն է:
Քննարկենք, թե ինչպես կարող է քիմիական կապ առաջանալ էլեկտրաբացասականությամբ միմյանցից կտրուկ տարբերվող ատոմների միջև, օրինակ` նատրիումի \((Na)\) և ֆտորի\((F):\)
Նատրիումի ատոմն իր արտաքին շերտի մեկ էլեկտրոնը տրամադրում է ֆտորի ատոմին և փոխարկվում է ութ էլեկտրոն պարունակող, կայուն, դրական լիցքավորված մասնիկի, այսինքն` ստացվում է նեոն \((Ne)\) իներտ գազի էլեկտրոնային կառուցվածք.
Ֆտորի ատոմն արտաքին էլեկտրոնային շերտում յոթ էլեկտրոն ունի, և կայուն վիճակի համար ֆտորի ատոմին ընդամենը մեկ էլեկտրոն է պակասում, ուստիև ավարտուն արտաքին էներգիական մակարդակ ստանալու համար շատ ավելի հեշտ է այդ ատոմին մեկ էլեկտրոն միացնել: Այդ մեկ էլեկտրոնը նատրիումի ատոմից վերցնելիս ֆտորի ատոմը փոխարկվում է \(8\) էլեկտրոն պարունակող, կայուն արտաքին շերտով, բացասական լիցքավորված մասնիկի այսինքն, ստացվում է նեոն \((Ne)\) իներտ գազի էլեկտրոնային կառուցվածք.
Դրական և բացասական մասնիկների միջև էլեկտրաստատիկական ձգողության ուժեր են ծագում, և որպես արդյունք՝ առաջանում է նատրիումի ֆտորիդ նյութը:
Իոնի լիցքը նշելիս նրա թվային արժեքը գրվում է \(«+»\) կամ \(«-»\) նշանով, ընդ որում՝ միալիցք իոնների դեպքում \(1\) թիվը չի գրվում:
Իոնները լիցքավորված մասնիկներ են, որոնք առաջանում են չեզոք ատոմներին էլեկտրոն միանալիս կամ էլեկտրոն տրամադրելիս:
Իոնի ձեռք բերած էլեկտրական լիցքն անվանվում է իոնի լիցք:
Այն քիմիական կապը, որն առաջանում է իոնների միջև գործող էլեկտրաստատիկական փոխազդեցության շնորհիվ անվանվում է իոնային:
Էլեկտրաստատիկական ուժերի ծագման հետևանքով ձևավորվում է այսպես կոչված իոնային բյուրեղավանդակը:
Իոնային բյուրեղավանդակ առաջացրած միացություններն էլ անվանվում են իոնային միացություններ:
Օրինակ
Իոնային կապ են առաջացնում նաև բարդ իոնները՝ լիցքավորված բազմատոմ մասնիկները, օրինակ՝ և այլն:
Դրանք նույնպես իոնային կապով են միանում տարանուն լիցքով ոններին՝ և այլն:
Այս դեպքում բյուրեղավանդակի հանգույցներում կանոնավոր դասավորվում են պարզ և բարդ իոնները:
Ուշադրություն
Իոնային կապը հագեցած չէ:
Ուշադրություն
Իոնային կապն ուղղորդված չէ:
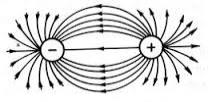
Իսկ տարբեր ուղղություններով գործող փոխազդեցության ուժերի գոյությունն ապացույց է, որ իոնային կապը հագեցած չէ: Այսպես, նատրիումի քլորիդի \((NaCl)\) բյուրեղներում նատրիումի յուրաքանչյուր իոն \((Na+)\) շրջապատված է քլորի \(6\) իոնով, քլորի յուրաքանչյուր իոն \((Cl)\)՝ նատրիումի \(6\) իոնով:
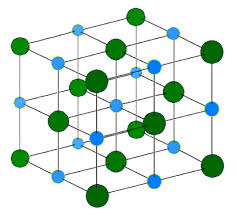
Իոնային միացությունների բյուրեղավանդակները կայուն են, ուստիև բնորոշվում են հալման ու եռման բարձր ջերմաստիճաններով: