
















Նյութի ագրեգատային վիճակները
Ցանկացած նյութ ունի տարբեր ագրեգատային վիճակներ: Այդ վիճակներն իրարից տարբերվում են ոչ թե մոլեկուլներով, այլ նրանով, թե ինչ դասավորություն ունեն այդ մոլեկուլները և ինչպես են շարժվում: Նույն նյութի (օրինակ՝ ջրի) ագրեգատային տարբեր վիճակներում մոլեկուլների դասավորության առանձնահատկությունները պատկերված են նկար 1-ում՝
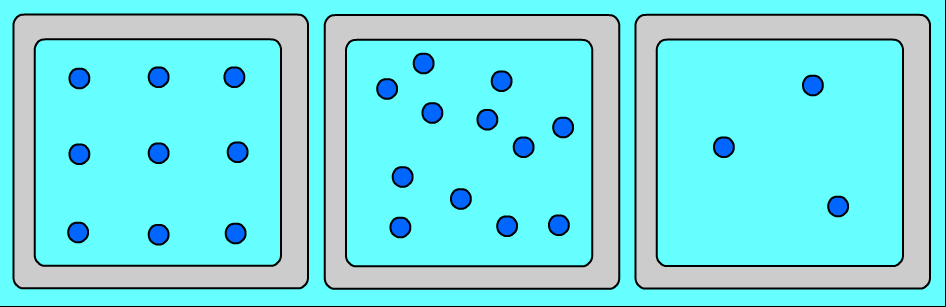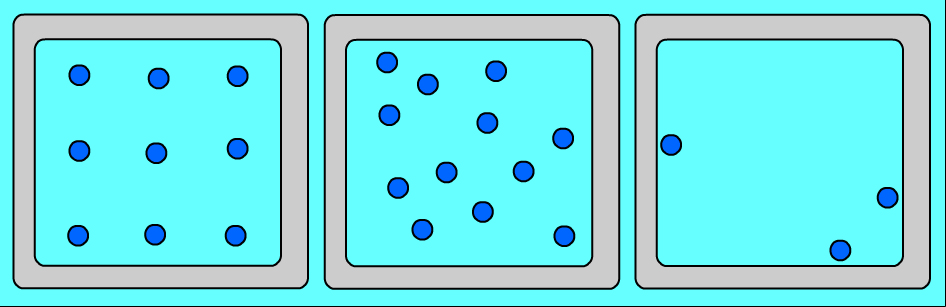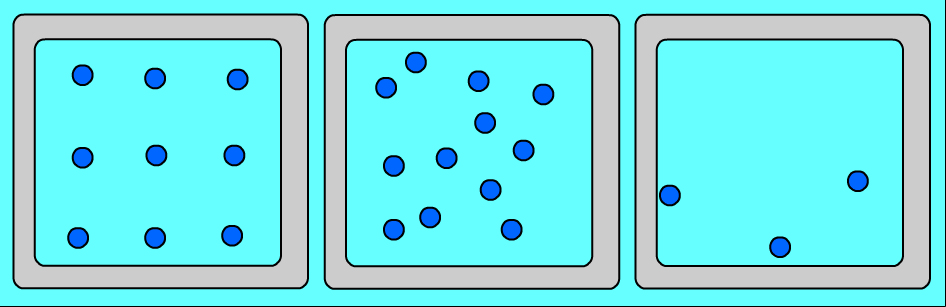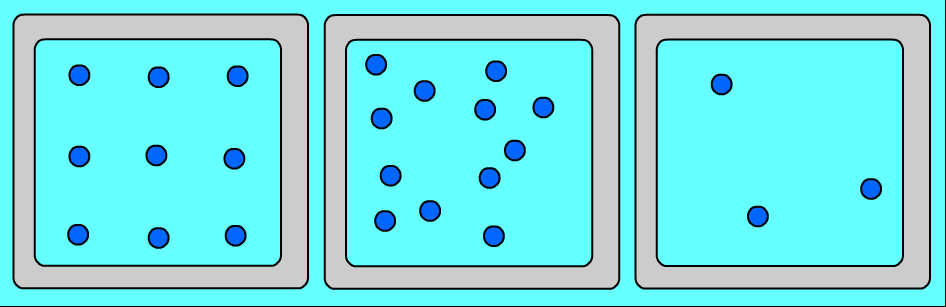
Ուշադրություն
Որոշակի պայմանների առկայության դեպքում նյութերը կարող են մի վիճակից անցնել մեկ այլ վիճակի:
Հնարավոր բոլոր փոխակերպումները պատկերված են նկար 2-ում:
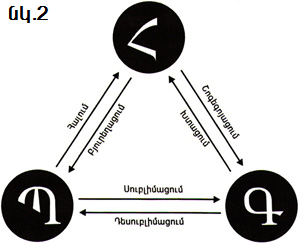
Գ Պ, Հ տառերը նյութերի՝ համապատասխանաբար գազային, պինդ, հեղուկ վիճակները նշանակելու համար են, սլաքները ցույց են տալիս այս կամ այն պրոցեսի
Պինդ (բյուրեղային) վիճակից նյութի անցումը հեղուկ վիճակի կոչվում է հալում, իսկ հակառակ պրոցեսը՝ բյուրեղացում կամ պնդացում:
Օրինակ
Հալման օրինակ է սառույցի հալումը, հակառակ պրոցեսը տեղի է ունենում ջրի սառցակալման ժամանակ:
Նյութի անցումը հեղուկ վիճակից գազայինի կոչվում է շոգեգոյացում, հակառակ պրոցեսը կոչվում է խտացում (կոնդենսացիա, լատ. «կոնդենսատիո»՝ «խտացում» բառից):
Օրինակ
Շոգեգոյացման օրինակ է ջրի գոլորշացումը, խտացման՝ ցողի առաջացումը:
Նյութի անցումը պինդ վիճակից գազայինի (շրջանցելով հեղուկ վիճակը) կոչվում է սուբլիմացիա (լատ. «սուբլիմո»՝ «բարձրացնում եմ» բառից), հակառակ պրոցեսը՝ դեսուբլիմացիա:


Օրինակ
Գրաֆիտը կարելի է տաքացնել մինչև հազար, երկու հազար և անգամ երեք հազար աստիճան, և այդուհանդերձ, այն չի վերածվի հեղուկի, այլ սուբլիմացիայի կենթարկվի, այսինքն՝ պինդ վիճակից միանգամից կանցնի գազայինի: Միանգամից գազային վիճակի է անցնում (շրջանցելով հեղուկ վիճակը) նաև, այսպես կոչված, «չոր սառույցը» (պինդ ածխածնի օքսիդը՝ \(CO2 )\), որը կարելի է տեսնել պաղպաղակի պահպանման և տեղափոխման համար նախատեսված բեռնարկղում: Բոլոր հոտերը, որոնցով օժտված են պինդ մարմինները (ասենք՝ նավթալինը), նույնպես պայմանավորված են սուբլիմացիայով. պինդ մարմնից մթնոլորտ դուրս գալով՝ մոլեկուլները նրա վրա գազ (կամ գոլորշի) են գոյացնում, ինչն էլ հոտի զգացողություն է առաջացնում: Դեսուբլիմացիայի օրինակ կարող է ծառայել ձմռանը լուսամուտների վրա սառույցի բյուրեղիկներից նախշերի առաջացումը: Դրանք օդում գտնվող ջրային գոլորշու դեսուբլիմացիայի արդյունքն են:
Բյուրեղային մարմինների հալումն ու պնդացումը
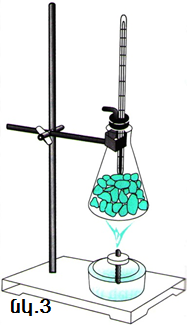
Բյուրեղային պինդ մարմինը հալեցնելու համար անհրաժեշտ է նրան որոշակի ջերմաքանակ հաղորդել: Կատարենք հետևյալ փորձը: Կոնաձև փորձանոթը լցնենք սառույցի մանր կտորներով (նկ. 3): Նրա մեջ ջերմաչափ տեղադրենք և խցանով փակելով փորձանոթը՝ սկսենք տաքացնել այն:
Եթե կառուցենք փորձանոթի նյութի ջերմաստիճանի՝ ժամանակից կախվածության գրաֆիկը, ապա կստանանք մի գիծ, որը պատկերված է նկար 4-ում:
Այս գրաֆիկի \(AB\) հատվածը նկարագրում է սառույցի \(-20-\) ից մինչև \(0°C \)տաքանալը: Տաք կոլբայի հետ շփման շնորհիվ սառույցի մոլեկուլների միջին
կինետիկ էներգիան մեծանում է, և սառույցի ջերմաստիճանը բարձրանում է: \(BC\) հատվածում ամբողջ էներգիան, որը ստանում է փորձանոթի պարունակությունը, ծախսվում է սառույցի բյուրեղային ցանցի քայքայման վրա. նրա մոլեկուլներն այնպիսի դասավորություն են ստանում, որի դեպքում նյութը հեղուկ է դառնում: Այդ ընթացքում մոլեկուլների միջին կինետիկ էներգիան անփոփոխ է մնում: Այդ պատճառով էլ անփոփոխ է մնում նաև նյութի ջերմաստիճանը: \(CD\) հատվածը նկարագրում է սառույցի հալումից առաջացած ջրի տաքանալը:
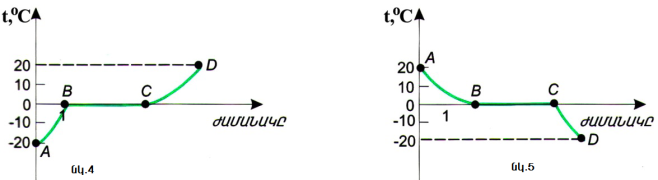
Այն ջերմաստիճանը, որի դեպքում նյութը հալչում է, կոչվում է հալման ջերմաստիճան:
Նկար 5-ում պատկերված է հակառակ պրոցեսի գրաֆիկը: Սկզբում ջուրը, էներգիա հաղորդելով, սառչում է \(20\)-ից մինչև \(0\) °: Այդ ընթացքում նրա մոլեկուլները աստիճանաբար սկսում են ավելի դանդաղ շարժվել: \(00\)°\(C\)-ում նրանք սկսում են որոշակի կարգով դասավորվել՝ ձևավորելով սառույցի բյուրեղային ցանցը: Քանի որ այս պրոցեսը, որը կոչվում է բյուրեղացում, չի ավարտվել, նյութի ջերմաստիճանը չի փոփոխվի:
Այն ջերմաստիճանը, որի դեպքում նյութը պնդանում է (բյուրեղանում է), կոչվում է այդ նյութի բյուրեղացման ջերմաստիճան:
Գրաֆիկից (տե՛ս նկ. 5) երևում է, որ ջերմաստիճանը, որի դեպքում ջուրը վերածվում է սառույցի, համընկնում է այն ջերմաստիճանին, որի դեպքում սառույցը դառնում է ջուր: Սա պատահական փաստ չէ:
Ուշադրություն
Փորձերը ցույց են տալիս, որ ամեն մի նյութ բյուրեղանում և հալչում է նույն ջերմաստիճանում:
Տարբեր նյութերի հալման (և պնդացման) ջերմաստիճանները կարելի է գտնել համապատասխան աղյուսակներում խնդրագրքերում և դասագրքերում: Այդ աղյուսակից երևում է, որ որոշ նյութեր (ասենք՝ ջրածինը և թթվածինը) հալվում և պնդանում են խիստ ցածր, մյուսները (ասենք՝ օսմիումը և վոլֆրամը)՝ շատ բարձր ջերմաստիճանների պայմաններում:
Ուշադրություն
Հալվելիս նյութը էներգիա է ստանում: Բյուրեղացման ընթացքում այն, ընդհակառակը, էներգիա է տալիս շրջապատող միջավայրին: Բյուրեղացման ժամանակ անջատվող էներգիան ստանալով՝ միջավայրը տաքանում է: Սա շատ լավ հայտնի է բազմաթիվ թռչունների: Դրա համար էլ ձմռան սառնամանիքին նրանց կարելի է տեսնել գետերի և լճերի սառցակալած մակերևույթին նստած: Բանն այն է, որ սառույցի առաջացման ժամանակ անջատվող էներգիայի շնորհիվ սառույցի վրայի օդը մի քանի աստիճանով ավելի տաք է լինում, քան անտառում՝ ծառերի վրա, և թռչունները դրանից օգտվում են:
Մարմնի հալման համար անհրաժեշտ և բյուրեղացման ընթացքում նրանցից անջատվող ջերմաքանակը
Ուշադրություն
Հալման ընթացքում մարմնի ջերմաստիճանը չի փոփոխվում: Այդ դեպքում նրա ստացած ամբողջ էներգիան ծախսվում է բյուրեղային ցանցը քայքայելու և մարմնի մոլեկուլների պոտենցիալ էներգիան մեծացնելու վրա:
Փորձով նույն զանգվածով տարբեր նյութերի հալման պրոցեսն ուսումնասիրելով՝ կարելի է նկատել, որ դրանք հեղուկի վերածելու համար տարբեր ջերմաքանակ է հարկավոր: Օրինակ՝ \(1\ կգ\) սառույցը հալելու համար անհրաժեշտ է ծախսել \(332\ կՋ\) էներգիա, իսկ \(1\) կգ կապարը հալելու համար՝ \(25\) կՋ:
Ֆիզիկական այն մեծությունը, որը ցույց է տալիս, թե ինչ ջերմաքանակ է անհրաժեշտ հալման ջերմաստիճանում գտնվող
Ուշադրություն
Հալման տեսակարար ջերմությունը չափում են ջոուլը բաժանած կիլոգրամով (Ջ/կգ) և նշանակում հունական \(λ\)(լամբդա) տառով. λ-ն հալման տեսակարար ջերմությունն է:
Ուշադրություն
Նյութի բյուրեղացման ընթացքում մոլեկուլների պոտենցիալ էներգիան նվազում է, և շրջակա միջավայր է արձակվում նույն ջերմաքանակը (ըստ մոդուլի), ինչքան կլանվում է նրա հալման ընթացքում: Ուստի, օրինակ, \(1\) կգ ջրի սառեցման ժամանակ անջատվում է այն նույն 332 կՋ էներգիան, որն անհրաժեշտ է նույն զանգվածով սառույցը ջրի վերածելու համար:
Տարբեր նյութերի հալման տեսակարար ջերմության արժեքները տրված են հավելված 3-ում: Այդ աղյուսակից երևում է, որ օրինակ, պղնձի հալման տեսակարար ջերմությունը՝
\(λ = 2,1· \)Ջ/կգ: Այս թիվը ցույց է տալիս, որ \(1\) կգ պղինձը հալելու համար պահանջվում է ծախսել \(2,1 ·\) Ջ էներգիա:
Ուշադրություն
Նույն ջերմաքանակը (ըստ մոդուլի) կանջատվի \(1\) կգ հեղուկ պղնձից նրա բյուրեղացման ընթացքում:
\(2\) կգ պղինձ հալելու համար կպահանջվի երկու անգամ ավելի էներգիա, \(3\) կգ-ի համար՝ երեք անգամ ավելի և այլն:
Հալման ջերմաստիճանում կամայական զանգվածով բյուրեղային մարմնի հալման համար անհրաժեշտ ջերմաքանակը գտնելու համար պետք է այդ մարմնի հալման տեսակարար ջերմությունը բազմապատկել նրա զանգվածով.
Ուշադրություն
Մարմնից անջատված ջերմաքանակը համարվում է բացասական: Ուստի \(m\) զանգվածով նյութի բյուրեղացման ընթացքում անջատվող ջերմաքանակը հաշվելիս պետք է օգտվել նույն բանաձևից, սակայն «մինուս» նշանով.
\(Q = - λm\ \)(2)
Ուշադրություն
Պետք է հիշել, որ (1) և (2) բանաձևերը կարելի է կիրառել միայն այնպիսի մարմինների նկատմամբ, որոնք արդեն գտնվում են իրենց հալման ջերմաստիճանում: Եթե մարմնի ջերմաստիճանը տարբերվում է իր հալման ջերմաստիճանից, ապա նախապես պետք է հաշվել այն ջերմաքանակը, որն անհրաժեշտ է մարմնի տաքացման համար, կամ որն անջատվում է մարմնից նրա սառեցման դեպքում:
Աղբյուրները
Ս. Վ. Գրոմով , Ն. Ա. Ռոդինա, Ֆիզիկա-8, հանրակրթական դպրոցի դասագիրք ( I, II, III և V գլուխների հեղինակ Ա. Մամյան); Երևան, Անտարես -2014 թ.