
















Պարբերական համակարգը և տարրերի հատկությունները

Քիմիական տարրերի պարբերական համակարգը ՊՀ բնության հիմնարար օրենքներից մեկի՝ Դ.Ի.Մենդելեևի հայտնագործած պարբերական օրենքի, գրաֆիկ պատկերն է: Գոյություն ունեն ՊՀ տարբեր ձևեր: Օրինակ՝
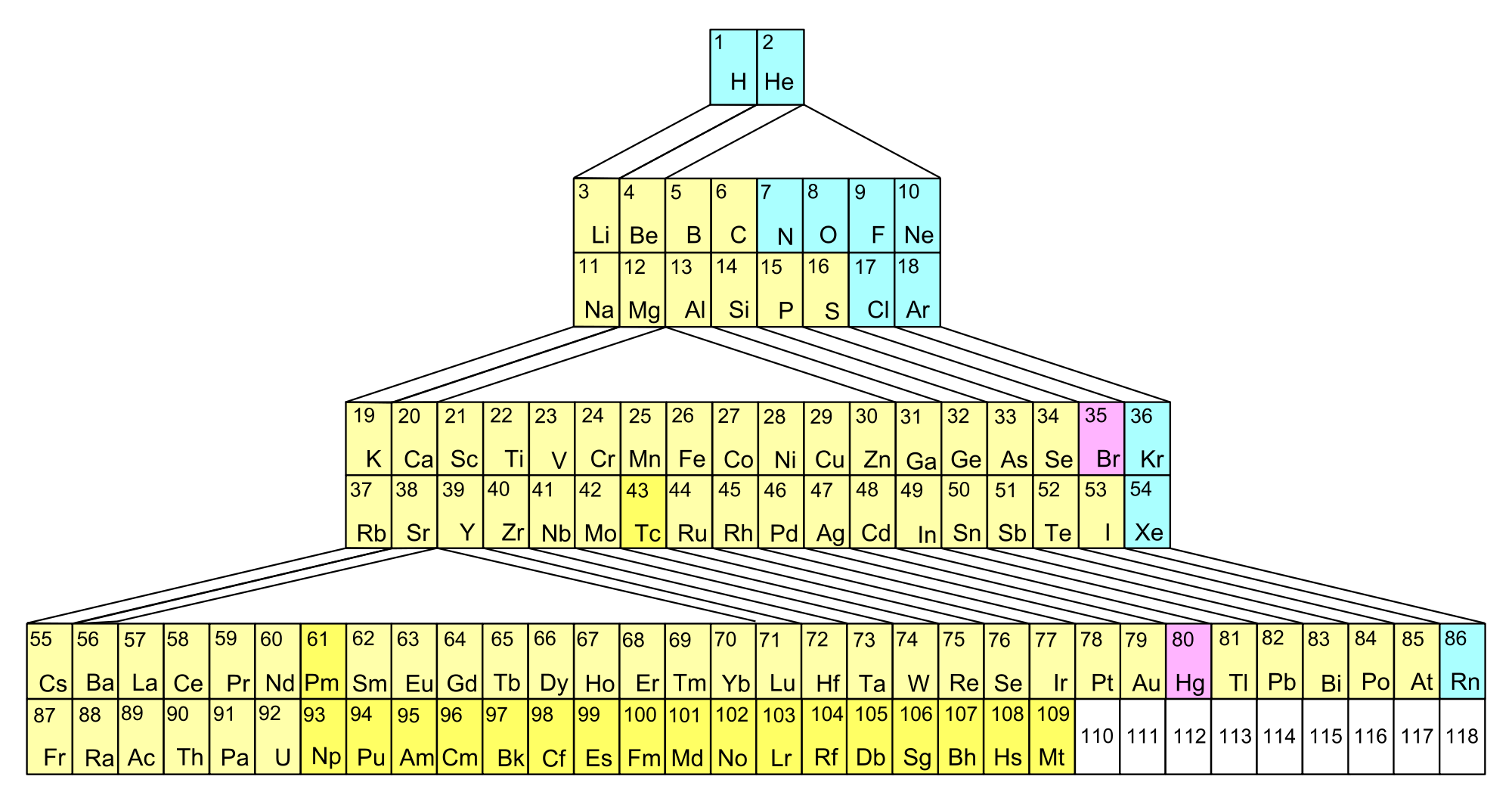
Գործնականում կիրառվում են, այսպես կոչված, երկար և կարճ ձևերը: Երկար ձևը կազմված է յոթ պարբերություններից և տասնութ խմբերից:
ՊՀ-ի կարճ ձևը կազմված է յոթ պարբերություններից և ութ խմբերից:
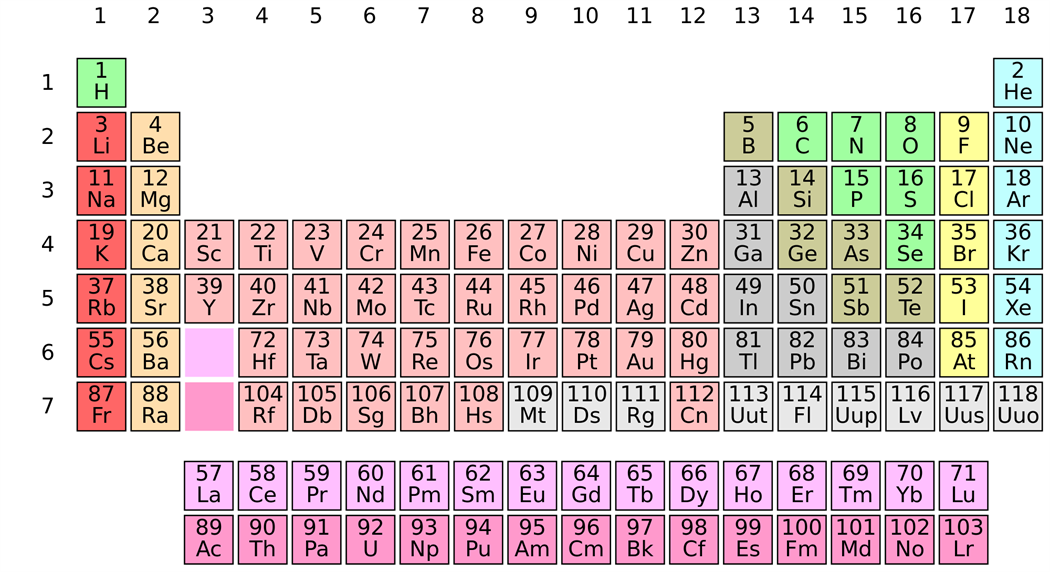
* \(1-3\) պարբերությունները կոչվում են փոքր, \(4-6\)՝ մեծ, իսկ \(7\)-ը՝ անավարտ:
* Յուրաքանչյուր խումբ կազմված է գլխավոր և երկրորդական ենթախմբերից: Գլխավոր ենթախումբերը ներառում են և՛ փոքր, և՛ մեծ պարբերությունների տարրեր, իսկ երկրորդական ենթախմբերը՝ միայն մեծ պարբերությունների տարրեր:
* Ըստ ատոմի էլեկտրոնային թաղանթում լրացվող վերջին էլեկտրոնի բնույթի, տարրերը բաժանվում են չորս խմբի՝ \(s-, p-, d-, f-\) տարրեր: \(I\) և \(II\) խմբերի գլխավոր ենթախմբերի տարրերը \(s-\) տարրեր են, \(III-VIII\) խմբերի գլխավոր ենթախմբերի տարրերը \(p\)\(-\) տարրեր են, երկրորդական ենթախմբերի բոլոր տարրերը \(d-\) տարրեր են, իսկ \(58-71\) և \(90-103\ \)կարգաթվով տարրերը՝ \(f-\) տարրեր:
* Պարբերության համարը ցույց է տալիս տվյալ պարբերության տարերի ատոմների էլեկտրոնային թաղանթում էներգիական մակարդակների, կամ էլեկտրոնային շերտերի թիվը:
Խմբի համարը ցույց է տալիս տարրի վալենտային էլեկտրոնների թիվը:
* Տարրի կարգաթիվը (ատոմային համարը) ցույց է տալիս միջուկի դրական լիցքը՝ պրոտոնների թիվը, և էլեկտրոնային թաղանթում առկա էլեկտրոնների թիվը:
Տարրի որոշիչ հատկանիշը միջուկի լիցքի մեծությունն է, ինչի հիման վրա էլ տրվում է պարբերական օրենքի ժամանակակից սահմանումը:
Քիմիական տարրերի ինչպես նաև դրանց միացությունների հատկությունները պարբերական կախման մեջ են միջուկի լիցքից:
Տարրից տարր միջուկի լիցքը մեծանում է մեկ միավորով, սակայն տարրերի հատկությունները փոխվում են պարբերական ձևով:
Օրինակ երկրորդ պարբերությունում՝

Նման օրինաչափությունները կրկնվում են նաև մյուս պարբերություններում:
- Տարրերի ատոմային շառավիղները պարբերություններում ձախից աջ փոքրանում են, իսկ ենթախմբերում վերևից ներքև՝ մեծանում:

- Տարրերի ատոմների իոնացման էներգիաները պարբերություններում ձախից աջ մեծանում են, իսկ ենթախմբերում վերևից ներքև՝ փոքրանում:
- Տարրերի էլեկտրաբացասականությունը պարբերություններում ձախից աջ մեծանում է, իսկ ենթախմբերում վերևից ներքև՝ փոքրանում:
Ուշադրություն
Պարբերական համակարգի գլխավոր ենթախմբերում վերևից ներքև տարրերին համապատասխանող պարզ նյութերի մետաղային հատկություններն ուժեղանում են, իսկ ոչ մետաղայինը՝ թուլանում: Նույն ուղղությամբ ուժեղանում են նաև տարրերին համապատասխանող օքսիդների և հիդրօքսիդների հիմնային հատկությունները և թուլանում թթվային հատկությունները:
- Պարբերություններում՝ ձախից աջ տարրերին համապատասխանող պարզ նյութերի ոչ մետաղային հատկություններն ուժեղանում են, իսկ մետաղայինը՝ թուլանում: Նույն ուղղությամբ թուլանում են նաև տարրերին համապատասխանող օքսիդների և հիդրօքսիդների հիմնային հատկությունները և ուժեղանում թթվային հատկությունները:
- Տարրերի ցնդող ջրածնային միացությունների ջրային լուծույթների թթվային հատկություններն ուժեղանում են պարբերություններում՝ ձախից աջ, իսկ խմբերում՝ վերևից ներքև:
Պարբերականության երևույթը կապված է քիմիական տարրերի էլեկտրոնային շերտերի կառուցվածքի պարբերական կրկնության հետ և պայմանավորված է հենց դրանով:
Աղբյուրները
Ա․ ԽԱՉԱՏՐՅԱՆ, Լ․ ՍԱՀԱԿՅԱՆ
Քիմիա-10, Երևան-2010