
















Վալենտականություն
Վալենտականությունը քիմիական տարրերի հիմնարար հատկություններից է, որը պայմանավորված է տարրի ատոմի էլեկտրոնային կառուցվածքով՝ տարրի վալենտային էլեկտրոնների թվով, վալենտային օրբիտալների թվով:
Վալենտականությունը ատոմի՝ այլ ատոմների հետ որոշակի թվով կովալենտային կապեր առաջացնելու հատկությունն է:
Օրինակ՝ ջրածինը, թթվածինը, ազոտը, ածխածինը հիմնականում միավալենտ, երկվալենտ, եռավալենտ և քառավալենտ տարրեր են:
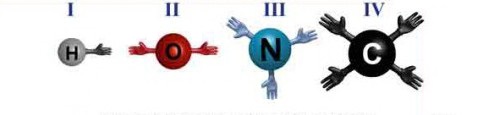
Օրինակ՝ ամոնիակի, մեթանի և ջրի մոլեկուլներում կապերի թիվը համապատասխանում է վերը ասվածին:
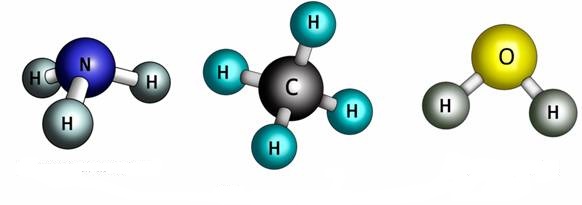
Վալենտականությունը այլ կերպ կարելի է սահմանել այսպես.
Վալենտականությունը քիմիական տարրի ատոմի առաջացրած կովալենտային կապերի թիվն է:
Տարրի վալենտականությունը առաջին հերթին պայմանավորված է չզույգված՝ կենտ էլեկտրոնների թվով:
Օրինակ՝ քլորը կարող է լինել միավալենտ, եռավալենտ, հնգվալենտ և յոթվալենտ՝ կախված ատոմի վիճակներից՝ հիմնական կամ գրգռված:
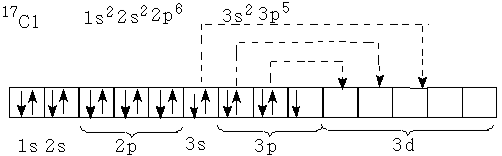
Տարրի վալենտային հնարավորությունը պայմանավորված է նաև վալենտային շերտում առկա չբաշխված էլեկտրոնային զույգերի թվով:
Օրինակ
Ազոտը եռավալենտ է կենտ էլեկտրոնների հաշվին, սակայն նա կարող է առաջացնել չորրորդ կովալենտային կապը՝ չբաշխված էլեկտրոնային զույգի հաշվին՝ դոնորակցեպտորային մեխանիզմով:
Ամոնիում իոնում և ազոտական թթվի մոլեկուլներում ազոտի ատոմը քառավալենտ է՝ էլեկտրոնային զույգի դոնոր է:
Ամոնիում իոնում և ազոտական թթվի մոլեկուլներում ազոտի ատոմը քառավալենտ է՝ էլեկտրոնային զույգի դոնոր է:
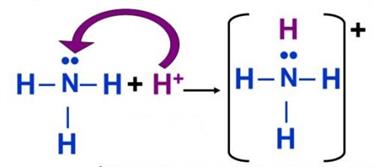
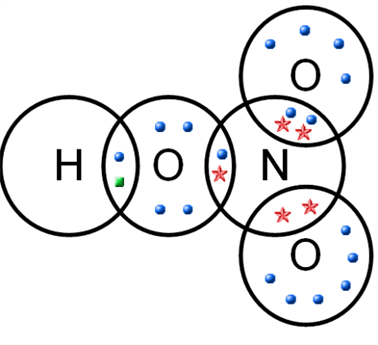
Ընդհանուր ձևով՝

Կամ մեկ այլ օրինակ՝ ածխածինը օքսիդներից մեկում քառավալենտ է ի հաշիվ փոխանակային եղանակով առաջացած չորս կովալենտային կապերի:
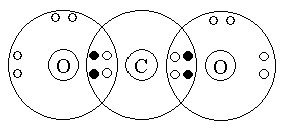

Իսկ մյուսում՝ եռավալենտ է ի հաշիվ փոխանակային եղանակով առաջացած երկու կապերի և դոնորակցեպտորային մեխանիզմով առաջացած մեկ կապի, ընդ որում ածխածնի ատոմը էլեկտրոնային զույգի ակցեպտոր է:
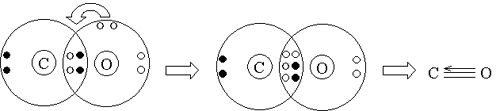

Այսպիսով՝ տարրի ատոմի վալենտային հնարավորությունները պայմանավորված են՝
* վալենտային էլեկտրոնային շերտում առկա կենտ էլեկտրոնների թվով
* չբաշխված էլեկտրոնային զույգերի թվով
* դատարկ օրբիտալների թվով
Աղբյուրները
Ա․ ԽԱՉԱՏՐՅԱՆ, Լ․ ՍԱՀԱԿՅԱՆ
Քիմիա-10, Երևան-2010