
















Մետաղների քիմիական հատկությունները
Այլ տարրերի ատոմների հետ փոխազդելիս մետաղների ատոմներն էլեկտրոններ են տրամադրում և, որպես արդյունք, միայն դրական լիցքավորված իոններ առաջացնում:
Օրինակ
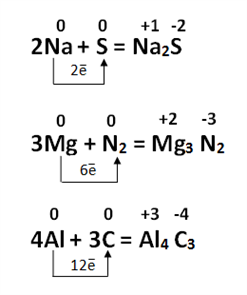
Մետաղների հետ փոխազդեցության ռեակցիաներում որպես օքսիդացնող կարող են հանդես գալ ոչ մետաղները, ջրածնի կատիոնները, այլ մետաղների կատիոններ և այլն:
Ալկալիական և հողալկալիական մետաղները, ջրի հետ փոխազդելով, հեշտությամբ վերականգնում են կատիոնները: Առաջանում են նաև լուծելի հիդրօքսիդներ` ալկալիներ ( և այլն):
Օրինակ

Պակաս ակտիվ մետաղները ջրի հետ փոխազդում են միայն տաքացման պայմաններում, և այս դեպքում առաջանում են ոչ թե հիդրօքսիդներ, այլ օքսիդներ:
Օրինակ
Ջրային լուծույթում մետաղի վերականգնող ակտիվությունը պայմանավորված է այն հանգամանքով, թե որքան հեշտ են մետաղի կատիոնները \((\)\()\) բյուրեղավանդակի հանգույցներից ջրի բևեռային մոլեկուլների ազդեցությամբ պոկվում ու լուծույթ անցնում: Որքան հեշտ են պոկվում, այնքան մետաղի վերականգնող հատկությունը մեծ է, իսկ թե որքանով այդ իոնները հեշտ կպոկվեն, կախված է մետաղի բնույթից՝ միջուկի լիցքից, ատոմի շառավղից:
Ըստ ջրային լուծույթում վերականգնող ընդունակության նվազման կարգի՝ մետաղները կարելի է դասավորել մի շարքով, որն անվանում են մետաղների էլեկտրաքիմիական լարվածության շարք:

Մետաղների էլեկտրաքիմիական լարվածության շարքում մետաղների դիրքից կախված՝ բխում են նրանց երկու հիմնական հատկությունները:
1. Մետաղների ակտիվության շարքում մինչև ջրածինը տեղադրված մետաղները թթուների լուծույթից ջրածին են դուրս մղում, իսկ աջ տեղադրվածները ջրածին դուրս չեն մղում:
Օրինակ
Այս կանոնի վերաբերյալ հարկ է նշել, որ.
ա) այն պահպանվում է, եթե թթվի ու մետաղի փոխազդեցությունից լուծելի աղ է ստացվում,
բ) խիտ ծծմբական թթուն և ցանկացած կոնցենտրացիայով ազոտական թթուն մետաղների հետ փոխազդում են, բայց ջրածին դուրս չի մղվում:
2. Յուրաքանչյուր մետաղ աղերի լուծույթներից դուրս է մղում այլ մետաղներ, որոնք լարվածության շարքում իրենից հետո են տեղադրված, իսկ ինքը դուրս է մղվում իրենից առաջ տեղադրվածներից:
Օրինակ
Այս կանոնը չի վերաբերում ալկալիական և հողալկալիական մետաղներին, քանի որ նրանք առաջին հերթին փոխազդում են ջրի հետ:
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015