
















Ծծմբաջրածին:

Ֆիզիկական հատկությունները:
Սովորական պայմաններում տհաճ հոտով (նեխած ձվի հոտը պայմանավորված է -ով), թունավոր, անգույն գազ է, վատ է լուծվում ջրում (նորմալ պայմաններում \(1\) ծավալ ջրում լուծվում է \(3\ \)լ ծծմբաջրածին)։

Ուշադրություն
Ծծմբաջրածինը խիստ թունավոր է, և նրա հետ կապված բոլոր փորձերը պետք է կատարել քարշիչ պահարանում:
Ստացումը:
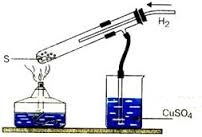
1) Ստացվում է հալված ծծմբի միջով ջրածին բաց թողնելիս.
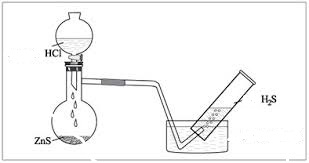
2) Սուլֆիդների և ուժեղ թթուների փոխազդեցությունից.
Քիմիական հատկությունները:
1. Ծծմբաջրածնի ջրային լուծույթն անվանում են ծծմբաջրածնային թթու, որը թույլ երկհիմն թթու է.
Ծծմբաջրածնային թթուն ցուցաբերում է թթուներին բնորոշ հատկությունները օրինակ՝ փոխազդում է հիմքերի հետ` առաջացնելով երկու տեսակի աղ` չեզոք` սուլֆիդներ և թթու` հիդրոսուլֆիդներ:
Մետաղների սուլֆիդները այրվում են, առաջացնելով համապատասխան մետաղի օքսիդ և ծծմբային գազ.
Օրինակ
2. -ը ցուցաբերում է շատ ուժեղ վերականգնող հատկություն ( իոնի հաշվին, որը կարող է միայն վերականգնող լինել, քանի որ համապատասխանում է ծծմբի նվազագույն օքսիդացման աստիճանին).
Օրինակ
3. Ծծմբաջրածնի որակական ռեակցիան ջրում և թթուներում չլուծվող \(PbS\) և \(CuS\) սև նստվածքի առաջացումն է.
Օրինակ


Կապարի սուլֆիդ Պղնձի\((II)\) սուլֆիդ
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015