
















Ծծումբ՝ պարզ նյութ: Ծծմբի քիմիական հատկությունները:

Ծծումբը գոյություն ունի հիմնականում \(3\) պարզ նյութի՝ տարաձևությունների տեսքով:
1. Շեղանկյուն ծծումբ - : Առավել կայուն ձևափոխությունն է:

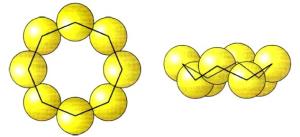
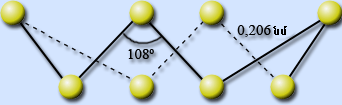
2. Ասեղնաձև (մոնոկլին) ծծումբ)` մուգ դեղին ասեղներ: Կայուն է \(96℃\) բարձր ջերմաստիճանում, սովորական ջերմաստիճանում փոխարկվում է շեղանկյուն ծծմբի:

3. Պլաստիկ շագանակագույն ռետինանման ամորֆ զանգված է, անկայուն է, արագ փոխարկվում է շեղանկյուն ծծմբի:

Ծծմբի ստացումը:
1. Արդյունաբերության մեջ ստանում են` բնածին ծծումբը հալելով ջրային գոլորշիներով:

2. Ծծմբաջրածնի ոչ լրիվ օքսիդացումից (թթվածնի անբավարարության պայմաններում).

Քիմիական հատկությունները:
Ծծմբի օքսիդացնող հատկությունը
Ծծմբի և ալկալիական մետաղների փոխազդեցությունն ընթանում է առանց տաքացման.

Ծծմբի և մյուս մետաղների փոխազդեցությունն ընթանում է տաքացման պայմաններում.
Օրինակ՝ երկաթի և ծծմբի փոխազդեցությունը

Հալված ծծմբի մեջ ջրածին անցկացնելիս առաջանում է ծծմբաջրածին.

Ծծմբի վերականգնող հատկությունը
Ծծումբը այրվում է կապտավուն բոցով՝ ծծմբի\((IV)\) օքսիդ առաջացնելով

Սենյակային ջերմաստիճանում ծծումբը փոխազդում է ֆտորի, քլորի, իսկ տաքացման պայմաններում՝ նաև բրոմի հետ:

Ծծումբը ֆտորի հետ առաջացնում է ծծմբի ֆտորիդ՝
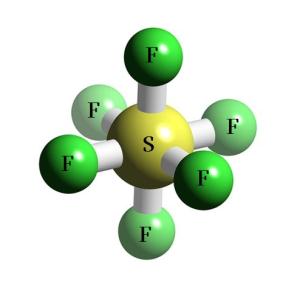
ծծմբի\((VI)\) ֆտորիդի մոլեկուլի մոդելը
Ծծումբը փոխազդում է խիտ ծծմական և ազոտոկոն թթուների հետ՝
Ծծմբի կիրառությունը:
Արդյունահանվող ծծմբի կեսից ավելին ծախսվում է ծծմբական թթու ստանալու համար: Ծծմբի կիրառման բնագավառներն են` կաուչուկի վուլկանացում` ռետինի ստացում, էբոնիտի ստացում, լուցկու արտադրություն, սև վառոդի ստացում, գյուղատնտեսության մեջ վնասատուների դեմ պայքար, բժշկության մեջ մաշկային հիվանդությունների բուժում:

Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015