
















Իոնների հատկությունները և կառուցվածքը
Համեմատենք նատրիում և քլոր տարրերի ատոմների՝ և համապատասխան իոնների՝ որոշ հատկությունները.
* էլեկտրոնային կառուցվածք.
-ի ատոմի արտաքին էլեկտրոնային շերտում \((\)\(M\)\()\) կա մեկ էլեկտրոն
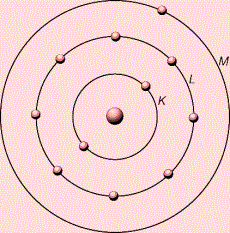
-ի ատոմի արտաքին էլեկտրոնային շերտում \((M)\) կա \(7\) էլեկտրոն:
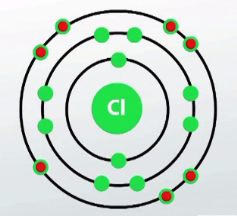
Իսկ համապատասխան իոններն արտաքին էլեկտրոնային շերտում ունեն ութական էլեկտրոն և նման են իներտ գազերի էլեկտրոնային կառուցվածքին.
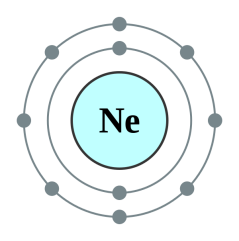
իոնն ունի իներտ գազ -ի էլեկտրոնային կառուցվածքը,
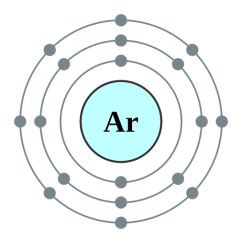
իոնն ունի իներտ գազ -ի էլեկտրոնային կառուցվածքը.

* ագրեգատային վիճակը


-պինդ -գազ
իոններն առանձին՝ ազատ վիճակում չեն կարող գտնվել, հետևաբար՝ ագրեգատային վիճակ հասկացությունն իոնների համար անիմաստ է:
* գույնը
, պարզ նյութ՝ արծաթավուն, -դեղնավուն, իսկ համապատասխան իոններն անգույն են:
* կենսաբանական ազդեցությունը.
և՛ , և՛ պարզ նյութերը խիստ թունավոր են, իսկ և՛ , և՛ իոնները խիստ անհրաժեշտ են կենդանի օրգանիզմների կենսագործունեության համար.


* քիմիական ակտիվությունը
և՛ -ը, և՛ -ը խիստ ռեակցիոնունակ են. նատրիումի և քլորի ատոմների միացումից առաջանում է նատրիումի քլորիդ՝ կերակրի աղ, որի կարևորությունը գիտի յուրաքանչյուր մարդ.
նատրիում և քլոր ատոմների
միացման շարժանկար
և՛ -ը, և՛ -ը խիստ պասիվ են, ունեն իներտ գազերի էլեկտրոնային կառուցվածք. .
* լիցքը
Ատոմները լիցք չունեն, չեզոք մասնիկներ են, իսկ իոնները լիցքավորված մասնիկներ են:
Իոնների կարևոր հատկություններից է գույնը: Գունավոր իոններ պարունակող նյութերի միջոցով հնարավոր է դառնում որոշ այլ իոնների որակական հայտաբերումը հետազոտվող լուծույթներում.



Աղյուսակ 1. ՈՐՈՇ ԻՈՆՆԵՐԻ ՈՐԱԿԱԿԱՆ ՌԵԱԿՑԻԱՆԵՐԸ
| Իոն | Ազդանյութ | Ռեակցիայի արդյունք |
| հայտանյութ | լակմուս՝ կարմիր ֆենոլֆտալեին՝ անգույն մեթիլնարնջագույն՝ կարմիր | |
| - | բոցը գունավորում է դեղին | |
| սպիտակ նստվածք | ||
| ՝ ամոնիակի սուր հոտ | ||
| ՝ ջրում և թթուներում չլուծվող, սպիտակ նստվածք |
| դեղին նստվածք | ||
| հայտանյութ | լակմուս՝ կապույտ ֆենոլֆտալեին՝ մորեգույն մեթիլնարնջագույն՝ դեղին |
*Իոններն՝ ըստ լիցքի, լինում են.
կատիոններ՝ դրական լիցք ունեցող մասնիկներ.
և այլն.
անիոններ՝ բացասական լիցք ունեցող մասհիկներ.
և այլն.
*Իոններն՝ ըստ բաղադրության, լինում են.
պարզ՝ միատոմանի. և այլն.
բարդ՝ բազմատոմանի. և այլն.
Յուրաքանչյուր անիոնի անվանում ձևավորվում է, հիմնականում, համապատասխան թթվի անվանման հիման վրա՝ ըստ իոնն առաջացնող տարրի լատինական անվանման, տարրի օքսիդացման աստիճանի հիման վրա՝ -ատ, -իտ, -իդ վերջածանցների միջոցով: Անհրաժեշտության դեպքում կիրառվում են որոշ նախածանցներ՝ -հիպո, -պեր- և այլն:
Օրինակ.
և այլն.
*Իոններն՝ ըստ գույնի, լինում են.
անգույն. և այլն.


գունավոր. և այլն.
օրինակ՝


Առանձնահատուկ կարևորություն ունի ջրածնի հիդրատացված իոնը՝ հիդրօքսոնիումը՝ , որն ստացվում է մաքուր ջրում ջրի մոլեկուլների ինքնադիսոցման միջոցով.
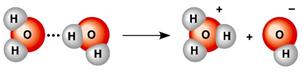
իսկ թթուների ջրային լուծույթներում՝ պարզապես հիդրատաման միջոցով.
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան, 2015