
















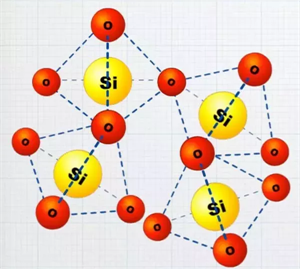
Սիլիցիումի \((IV)\) օքսիդ
Սիլիցիումի \((IV)\) օքսիդը (քվարցը) ատոմային բյուրեղավանդակով, կարծր, դժվարահալ նյութ է: Այս օքսիդը համարվում է անօրգանական պոլիմեր \((\)\()\), որի կրկնվող օղակն է՝ -ը:
Քիմիական հատկությունները
Սիլիկաթթվի անհիդրիդը՝ սիլիցիումի (IV) օքսիդը թթվային օքսիդ է, սակայն ի տարբերություն այլ թթվային օքսիդների, ջրում չի լուծվում և վերջինիս հետ չի փոխազդում:
Օրինակ


Կալիումի սիլիկատ Բարիումի սիլիկատ
Սենյակային ջերմաստիճանում սիլիցիումի \((IV)\) օքսիդը լուծվում է ֆտորաջրածնական թթվում:
Արդյունաբերությունում մի շարք սիլիկատներ ստանալու նպատակով սիլիցիումի \((IV)\) օքսիդը միահալում են համապատասխան աղերի հետ:
Օրինակ
Քվարցը դանդաղ փոխազդում է հալված նատրիումի կարբոնատի հետ և ստացվում է նատրիումի սիլիկատ (հեղուկ ապակի):
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015