
















Ազոտի ենթախմբի ընդհանուր բնութագիրը
Մենդելեևի պարբերական համակարգի \(VA\) խումբը կոչվում է ազոտի ենթախումբ, որի մեջ ընդգրկված են ազոտ` \(N,\) ֆոսֆոր` \(P\), արսեն` \(As\), ծարիր` \(Sb\), և բիսմութ` \(Bi\), տարրերը: Դրանք բոլորն էլ \(p\)-տարրեր են, արտաքին էլեկտրոնային թաղանթում ունեն հնգական էլեկտրոն:

Այս տարրերի ատոմի շարավիղը կարգաթվի մեծացման հետ մեծանում է, ուստի փոքրանում է էլեկտրաբացասականությունը և, բնականաբար, մետաղական հատկությունները մեծանում են:
Ահա թե ինչու ազոտը և ֆոսֆորը տիպական ոչ մետաղներ են, արսենն ու ծարիրը նաև մետաղական հատկություներ են ցուցաբերում, իսկ բիսմութը մետաղ է:
Քննարկվող ենթախմբի տարրերի ատոմների արտաքին էներգիական մակարդակներում առկա են հնգական էլեկտրոններ (երեքը զույգված չեն)։
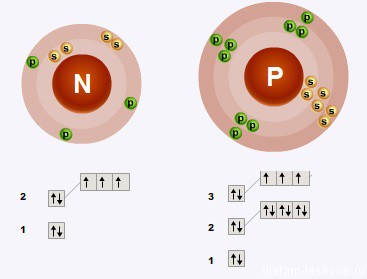
Ուստի այս ենթախմբի տարրերի ատոմները կարող են այլ տարրերի ատոմներին երեք էլեկտրոն միացնել՝ համապատասխան միացություններում \(-3\) օքսիդացման աստիճան դրսևրելով (բացասական օքսիդացման աստիճանը ծարիրին և, հատկապես, բիսմութին բնորոշ չէ):
Սակայն դա տեղի է ունենում միայն իրենցից ավելի փոքր էլեկտրաբացասականությամբ տարրերի, օրինակ՝ ջրածնի ու մետաղների ատոմներին միանալիս, իսկ ավելի մեծ էլեկտրաբացասականությամբ տարրերի ատոմներին միանալիս \(VA\) խմբի տարրերի ատոմներն էլեկտրոններ են տրամադրում ու լիցքավորվում դրական:
Ազոտը միացություններում կարող է ցուցաբերել \(-3,-2,-1, 0,+1,+2,+3,+4,+5,\) ֆոսֆորը՝ \(-3, 0, \)\(+1, +2, +3, +4, +5,\) արսենը՝ \(-3, 0, +3, +5\), ծարիրը՝ \(-3, 0, +3, +4, +5\), իսկ բիսմութը՝ \(0, +2, +3, +4, \)\(+5\) օքսիդացման աստիճաններ:
\(VA\) խմբի տարրերի կարևոր օքսիդներն են , որտեղ \(R\)-ն ազոտի ենթախմբի ցանկացած տարր է։ Այդ օքսիդներին համապատասխանում են թթուները:
Օրինակ՝
\(VA\) խմբի տարրերի օքսիդների ու հիդրօքսիդների թթվային հատկությունները կարգաթվի աճման հետ թուլանում են, իսկ նույն տարրի առաջացրած թթուն թթվի համեմատ շատ ավելի թույլ է։
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015